 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Крохмаль модифікований кислотою.
Кислотний гідроліз за температури нижче температури клейстеризації має місце в аморфних зонах крохмального зерна, залишаючи кристалічні зони відносно не задіяними, причому в більшій ступені проходить гідроліз амілопектину, а не амілози. За звичай його отримують шляхом обробки крохмальної суспензії хлоридною або сульфатною кислотою за температури 25 – 55°С, при цьому термін обробки залежить від показника в’язкості, яку хочуть отримати, і може скласти 6 – 24 години. Цей крохмаль практично нерозчинний в киплячій воді. Завдяки здатності цього крохмалю утворювати гарячі концентровані клейстери, які при охолодженні дають гель, його можна з успіхом використовувати в якості помягшувача при виробництві цукерок, а також отримання захисних плівок. Етерофіковані крохмалі. Оскільки D-глікопіранозилмономер (С3) може бути від 0 до 3. вважається, що комерційно більш доцільні похідні, які мають С3 менше ніж 0,1. така модифікація приводить до певних змін колоїдних та інших властивостей, які суттєві для харчових продуктів. введення гідроксиетильних груп при низькій С3 призводить до зниження температури клейстеризації, збільшенню швидкості набухання зерен, зменшує тенденцію до гелеутворенню і ретроградації. Вони використовуються як харчові добавки-загущувачі в салатних приправах, начинках. Ацетати крохмалю з низькою ступінню заміщення отримують обробкою зерен крохмалю оцтовою кислотою або краще її ангідридом за наявності каталізатора (як правило при рН 7 – 11; t° = 25°С; С3 = 0,5). Розчини ацетатів крохмалю дуже стабільні, оскільки наявність ацетил-груп Ацетати крохмалю в порівнянні зі звичайним кукурузним крохмалем мають нижчу температуру клейстеризації, занижену здатність до ретроградації, утворюють прозорі і стабільні клейстери. Завдяки цим властивостям ацетати крохмалю використовують в заморожених продуктах пекарських виробах, інстант-порошках і т. д. Глікоген Глікоген – тваринний крохмаль, є запасним полісахаридом в організмі людей та тварин, це найважливіше джерело енергії. Глікоген міститься в усіх клітинах живого організму, проте найбільше його у печінці (до 20% від сирої маси) та у м'язах (до 4%). Він міститься також у дріжджах та вищих грибах. Глікоген можна виділити з тваринних тканин дією розчину трихлороцтової кислоти на холоді (w = 5 – 10%), або розчином КОН = 60%) і за температури 100 °С з наступним осадженням етанолом. Глікоген – білий аморфний порошок, добре розчинний навіть у холодній воді, в якій він утворює опалесцюючий розчин. Розчин глікогену обертає площину поляризації світла вправо, кут питомого обертання його +196°. Молекула глікогену побудована із залишків α-D-глюкопіраноз, сполучених переважно глікозидним зв'язком α-(1→4). Близько 7 – 9% зв'язків становлять α-(1→6)-глікозидні зв'язки і близько 0,5 – 1% α-(1→3)-глікозидні зв'язки. Глікоген за будовою нагадує амілопектин, і його молекули ще більш розгалужені. Зовнішні ланцюги молекул довші, ніж внутрішні. Від амілопектину глікоген відрізняється тим, що у нього більше бічних ланцюгів розгалуження повторюються через кожні 8 – 16 залишків глюкози. Загальна кількість залишків глюкози у молекулі глікогену вища, ніж у молекулах амілопектину. Молекулярна маса глікогену досягає багатьох мільйонів одиниць, а ступінь полімеризації 2500 – 25000. З йодом розчини глікогену дають забарвлення від винно-червоного до червоно-бурого залежно від походження глікогену. Глікоген легко гідролізується кислотами до глюкози. В організмі тварин і людей глікоген синтезується з глюкози і накопичується в тканинах, а в період між вживанням їжі він розщеплюється за участю ферменту α-амілази або фосфорилази і фосфатної кислоти (амілоліз або фосфороліз). Проте кількість глікогену, яка може відкластися про запас у тканинах, обмежена. Після запасання 50 – 60 г глікогену на кілограм тканини з глюкози починає синтезуватися жир, а не глікоген. З цього часу починається ожиріння організму. Процес утворення глікогену з глюкози і відкладання його в печінці і частково у м'язах активується гормоном підшлункової залози інсуліном. Кількість глікогену в печінці змінюється. Під час голодування, посиленої роботи м'язів, нестачі вітамінів тощо відбувається різке зниження вмісту глікогену, а за великої кількості вуглеводів, що поступають з їжею, кількість глікогену може збільшуватися. Крім печінки та м'язів, глікоген відкладається в незначних кількостях в усіх тканинах та органах. За наявності надлишку вуглеводів в їжі та наявності великої кількості глікогену в печінці та м'язах спостерігається перетворення вуглеводів в жири. Інулін До резервних полісахаридів відноситься інулін. Цей полісахарид складається із залишків b-D-фруктофуранози, поєднаних 2,1-глікозидним зв'язком причому, на одному кінці ланцюга і в середині розміщується по одному залишку глюкопіранози. Його емпірична формула (C6H10O5)n молекулярна маса інуліну не перевищує 5000 – 6000 умовних одиниць при довжині ланцюга 38 – 45 гексозних ланок. Розчини інуліну обертають площину поляризованого світла вліво, кут питомого обертання –39°. Інулін гігроскопічний, легко розчинний у гарячій воді і важко – у холодній. Міститься в бульбах жоржин (10 – 12%), корені цикорію (10%), топінамбурі, артишоках, кок-сагизі, девясилі та інших речовинах. Розчин інуліну йодом не забарвлюється.
Фрагмент молекули інуліну Естери інуліну і нікотинової кислоти – ефективні засоби регулювання кров'яного тиску. Припускають наявність в інуліну антигенної активності, а у зв'язку з цим можливості використання його для одержування антитіл різної специфічності. Клітковина Клітковина (целюлоза) складається із залишків b-D-глюкопіранози, що поєднані 1,4-глікозидним зв'язком:
Фрагмент молекули клітковини Клітковина має молекулярну масу від 100 тис. до 1 млн. Вона не розчиняється у воді. Завдяки своїй стійкості це найбільш поширений в світі біополімер. Характерною особливістю клітковини, яка визначає в основному її механічні, фізико-хімічні та хімічні властивості, є лінійна конформація її молекул, яка зміцнена внутрішньо молекулярними водневими зв'язками. Лінійна макромолекули клітковини, розташовуючись приблизно паралельними пучками, утворюють за рахунок додаткових міжмолекулярних водневих зв'язків структури, регулярні у трьох вимірах, що характерно для кристалів. У волокні клітковини між кристалічними фрагментами розташовуються аморфні, наявністю яких обумовлена висока механічні міцність і нерозчинність волокон, проте як набрякання і реакційна здатність пов'язані з більш легко проникними для хімічних реагентів аморфними фрагментами. Клітковина виконує роль опорного матеріалу і є складовою частиною оболонок рослинних клітин. Клітковина має високу механічну міцність, розщеплюється спеціальним ферментом целюлазою в організмі травоїдних тварин. Ферменти шлунково-кишкового тракту людини не розщеплюють клітковину, тому її відносять до баластних речовин або харчових волокон. Клітковина посилює виділення жовчі, що сприяє кращому виведенню з організму холестерину. Ця її властивість використовується в лікувальному харчуванні при захворюваннях печінки, жовчного міхура, а також при атеросклерозі. Тому що клітковина викликає відчуття ситості після їжі і знижує засвоюваність основних харчових речовин, її у вигляді овочів, ягід та виробів з висівок призначають при надмірній повноті та цукровому діабеті. Макромолекули клітковини мають лінійну волокнисту будову. Це волокниста речовина, міцна, без кольору, без запаху, не дає забарвлення з йодом, не розчиняється у воді і органічних розчинниках. Розчиняється в деяких розчинниках (наприклад, реактив Швейцера). Клітковина стимулює перистальтику кишківника, нормалізує життєдіяльність корисної кишкової мікрофлори, сприяє виведенню з організму холестерину. Геміцелюлози — гетерополісахариди із порівняно невисокою молекулярною масою. Вони мають більш менш лінійну структуру молекул, але не утворюють фібрилярних структур і разом з пектиновими речовинами, які побудовані в основному з залишків уронових кислот, відіграють у клітинній стінці рослини роль матеріалу-цементу. До геміцелюлоз відносяться такі гетерополісахариди, як глюкоманани галактоманани ксилани що містять у бокових ланцюгах залишки манози, галактози, арабінози, ксилоли, глюкози та інших моносахаридів. Геміцелюлози широко використовуються для одержання кормових та харчових продуктів, серед яких слід відмітити агар, агарозу, ксиліт. Геміцелюлози відносяться до групи харчових волокон, які необхідні для нормального травлення.
Фрагмент молекули геміцелюлози глюкоманану До пектинових речовин відносяться поліуроніди, які присутні у розчинній або нерозчинній формі практично у всіх наземних рослинах і деяких водоростей. Нерозчинні пектинові речовини, такі як протопектин, скидають більшу частину міжклітинної речовини і первинної стінки молодих рослинних клітин. Особливо багаті протопектином тканини, клітини Яких не мають вторинної стінки, наприклад м'якоть плодів. Розчинні пектинові речовини містяться в основному у соках рослин. При дозріванні і зберіганні плодів нерозчинні форми пектину переходять в розчинні, з цим пов'язано пом'якшення плодів при дозріванні і зберіганні. Перехід нерозчинних форм пектину в розчинні відбувається під час теплової обробки рослинних продуктів. ' Найбільша кількість пектинових речовин знаходиться в плодах і коренеплодах. Отримують пектини з яблучних вичавків, буряка, кошиків соняшнику, цитрусових. Головним моносахаридом, який входить до складу пектинових речовин, є D-галактуронова кислота, присутніми у меншій кількості є L-арабіноза і D-галактоза, рідко – D-ксилоза, L-фруктоза та ін. Частина залишків уронових кислот у пектинових речовинах етерифікована метиловим спиртом. Такі частково етерифіковані поліуроніди називають пектиновими кислотами, а полікарбоксильні сполуки – пектовими кислотами.
Фрагмент молекули пектинової кислоти
Фрагмент молекули пектової кислоти
Важливою властивістю пектинових речовин е утворення їх розчинами міцних гелів або драглів. Драглеутворення обумовлено міжмолекулярною асоціацією. Цьому процесу сприяє наявність у розчині сахарози і органічних кислот (лимонної, винної та ін.), що пов'язано з порушенням сольватації полімерних молекул у присутності цих сполук. Сильний вплив на властивість до драглеутворення має наявність у розчині неорганічних солей і ступінь етерифікації карбоксильних груп полісахаридів. Пектинові речовини як драглеутворювачі широко використовуються у виробництві мармеладу, пастили, желе і джемів, а також в хлібопеченні, сироварінні. У харчовому виробництві джерелом пектинових речовин є яблука або лимони. До фітополісахаридів відносяться також слизи, гуми (камеді). Камеді – це полісахариди, які виділяються у вигляді в'язких розчинів і утворюють склоподібну масу при порушенні цілісності кори багатьох дерев, оболонки рослин. Властивість утворювати камеді розповсюджена у рослин дуже широко. Найбільш відомі камедоносні рослини відносяться до родини бобових, трояндоквітним та ін. Камеді є гетерополісахаридами, які складаються з декількох моносахаридів, серед яких може бути одна або кілька уронових кислот. Завдяки підвищеній в'язкості, клейкості, набряканню та іншим цінним властивостям камеді широко використовуються у харчовому виробництві як емульгаторц, згущувачі, зв'язуючи речовини та стабілізатори. Слизи – полісахариди, подібні до камедей, але містяться у непошкоджених рослинах. Джерелом слиз є кора, корні, листя, насіння та ін. Значну кількість слизів містять зерна жита та льону, звідки їх екстрагують водою. На сьогоднішній день слизи і камеді практично не розрізняють за хімічною будовою, але відмічають, що серед слизів більше полісахаридів з відносно простою структурою. Серед слизів зустрічаються багато нейтральних гетеро- і гомополісахаридів. Слизи набухають у воді і утворюють в'язкі розчини, Слизи овочевих рослин – гідрофільні полісахариди, які накопичуються в насінні, корінцях та інших продуктових органах у слизових ходах. За хімічним складом нейтральні слизи подібні до геміцелюлози, а кислі – до камеді. Слизи відіграють важливу роль під час набухання та проростання насіння, Наприклад, вже через декілька годин посіяне насіння кавуна покривається слизовою оболонкою і для такої насінини уже не страшні різкі перепади вологості ґрунту. Найбільшим шаром слизу покривається насіння васильків (базиліку), льону та подорожнику, що навіть перешкоджає висіванню намоченого насіння. Товсті слизові оболонки навколо насіння утворює кавун слизистонасінний та момордіка. Овочеві рослини з великою кількістю слизу дуже корисні для приготування дієтичних страв, які лікують гастрити та виразки шлунку. Полісахариди морських водоростей за своєю будовою суттєво відрізняються від полісахаридів наземних рослинних організмів. Хоча клітковина, яка приймає участь у побудові клітинних стінок водоростей, подібна звичайній клітковині, основну масу цих стінок і міжклітинної речовини складають так звані слизи водоростей — агар, карагінан та альгінова кислота та ін. Агар і карагінан одержують у промисловому масштабі з багатьох видів червоних водоростей. Агар є сумішшю полісахаридів агарози та агаро- пектину. Агароза побудована з D-галактози і 3,6-ангідро-L-галактози. Альгінову кислоту одержують з бурих водоростей.
Фрагмент молекули альгінової кислоти Полісахариди водоростей широко використовуються у харчовому, текстильному та ін. виробництвах. Поєднуючи тканина тваринних організмів містить значну кількість кислих мукополісахаридів. Це лінійні полімери з молекулами, які побудовані із залишків аміноцукрів та уронових кислот. Кислі властивості багатьох з них обумовлені наявністю карбоксильних груп і присутністю залишків сульфатної кислоти. Кислі мукополісахариди у поєднуючій тканині утворюють комплекси з білками. До таких полісахаридів відносяться гіалуронова кислота. Повний кислотний гідроліз цього полісахариду дає глюкозамін, оцтову кислоту, оксид карбону в результаті декарбоксилування уронової кислоти.
Фрагмент молекули гіалуронової кислоти Важливою властивістю гіалуронової кислоти є утворення розчинів високої в'язкості. На цю властивість сильно впливає іонна сила і рН розчину. Бродіння вуглеводів Процеси бродіння моносахаридів широко використовуються у харчових технологіях у виробництві хліба, пива, квасу, спирту, вина тощо. Бродіння – це процес розщеплення моносахаридів під дією різних факторів, мікроорганізмів. Бродіння розрізняють – спиртове, молочнокисле, маслянокисле і лимоннокисле.
Спиртове бродіння протікає під впливом мікроорганізмів і відіграє важливу роль у виробництві спирту, вина, хлібобулочних виробів. Поряд з основними продуктами, які одержують під час спиртового бродіння, спирту і діоксидом карбону, в результаті бродіння утворюються такі сполуки, як гліцерин, янтарна кислота, оцтова кислота, ізоаміловий та ізопропіловий спирти та інші. Ці продукти суттєво впливають на смак і аромат харчових продуктів. Молочнокисле бродіння відбувається під час одержання кефіру та інших молочнокислих продуктів, сиру, квашенні капусти. Відомі дві групи молочнокислих бактерій. У першу з них входять гомоферментативні бактерії, які утворять тільки молочну кислоту. Молочнокислі бактерії другої групи (гетероферментативні бактерії) утворюють, крім молочної, ще й оцтову кислоту, а також етиловий спирт (нерідко в досить значних кількостях), вуглекислий газ, мурашину кислоту та інші продукти. Співвідношення між цими продуктами залежить від багатьох умов (температура, рН середовища та ін.). Найчастіше це обумовлено спільною діяльністю молочнокислих бактерій із дріжджами. Такого роду спільні «закваски» часто створюються штучно і широко використовуються при випіканні хлібу, у виробництві хлібного квасу і ряду молочнокислих продуктів (сир, кефір, кисляк, кумис тощо). Широко застосовується молочнокисле бродіння у виробництві молочної кислоти, яка використовується у ряді галузей харчової промисловості. В результаті маслянокислого бродіння утворюється масляна кислота. Цей процес відбувається під час тривалого зберігання харчових продуктів. Масляна кислота має гіркий присмак. Накопичення цієї кислоти у складі продуктів погіршує їх смакові якості. Лимоннокисле бродіння відбувається під дією пліснявих грибків. Промислове одержання лимонної кислоти відбувається шляхом зброджування грибом Aspergillus піgег розчину сахарози. ЛІПІДИ Ліпідами (від грецьк. lipos – жир) називається велика група природних сполук, які відіграють значну роль у життєдіяльності всіх живих організмів (тварин, рослин, бактерій тощо). Разом з білками та вуглеводами вони становлять основу структури клітинних і тканинних мембран таких організмів. Ліпіди сприяють утворенню енергетичного резерву (депо) в організмі, захищають тканини від дії механічного впливу, температури, води. Класифікація ліпідів. До складу ліпідів входять різні за хімічною будовою структурні компоненти – вищі карбонові кислоти (ВКК), вищі спирти (ВС), аміноспирти, гліцерин, діоли, неорганічні кислоти (фосфатна), які утворюють здебільшого відповідні естери, а також етери та інші похідні. Така структурна різноплановість ліпідних речовин значно ускладнює їхню хімічну класифікацію. Загальною рисою ліпідів є нерозчинність у воді та розчинність в органічних розчинниках (нижчих спиртах, хлороформі та інших галогеналканах, бензені, ацетоні, діалкілових етерах, оліях). На цій загальній властивості ґрунтується віднесення до ліпідів таких сполук, як ВКК та їх естери (жири), ВС та їх естери з ВКК (воски), інші естери ВКК з аміноспиртами тощо. В основу сучасної хімічної класифікації ліпідів покладений принцип структурної подібності речовин, згідно з яким ліпіди поділяються на групи: Прості ліпіди – це ліпіди, які не містять атомів Нітрогену, Фосфору, Сульфуру. Це естери ВКК і спиртів: жири, воски. Складні ліпіди, молекули яких містять не тільки залишки високомолекулярних карбонових кислот, але і фосфатну або сульфатну кислоти. Це фосфоліпіди, гліколіпіди (цереброзиди). Єдиної системи класифікації ліпідних сполук практично немає. Віднесення до ліпідів сполук ізопреноїдної будови (каротини, вітаміни А), стероїдів (стерини, жовчні кислоти, гормони), деяких жиророзчинних вітамінів тощо є дискусійним і остаточно ще не вирішеним питанням. Загальною властивістю цих сполук з ліпідами є нерозчинність у воді і розчинність у органічних розчинниках. ПРОСТІ ЛІПІДИ До основних простих ліпідів належать такі найпоширеніші природні сполуки, як жири, а також воски. Жири Жири – це естери гліцерину та вищих карбонових кислот. Загальна формула:
де R′, R″, R″′ – радикали (алкільні залишки) вищих жирних карбонових кислот. Хімічну природу жирів уперше дослідив у 1822 році французький хімік М. Шеврель, який здійснив їхній гідроліз при нагріванні з водою в присутності лугу. У 1854 році М. Бертло довів будову жирів, отримавши їх шляхом нагрівання гліцерину з вищими жирними кислотами в ампулах.
Гліцерин входить до складу усіх природних жирів. Оскільки при лужному гідролізі утворюються карбонові кислоти, останні отримали назву жирні кислоти або за сучасною абревіатурою – ВКК. Зрозуміло, що різниця між різними жирами за фізичними та хімічними властивостями обумовлена виключно кислотами. Нині відомо біля 50 природних насичених і ненасичених карбонових кислот, найпоширеніші з яких у складі жирів подано у табл. 1. Таблиця 1. Найважливіші кислоти, які виділені з природних жирів
Для виділення кислот із жирів використовують різні методи: перегонку метилових ефірів, кристалізацію за низьких температур, утворення комплексів з сечовиною і з циклічними декстринами, хроматографію (паперову та газову – найефективніший метод на сьогодні). Жирні кислоти, що містять один або більше подвійних зв’язків називаються ненасиченими карбоновими кислотами (олеїнова – С17Н33СООН, лінолева – С17Н31СООН, ліноленова – С17Н29СООН). Ступінь насиченості жирних кислот, які входять до складу жирів та інших ліпідів, визначає їх агрегатний стан: чим вище ненасиченість жирних кислот та менше атомів Карбону, тим нижче температура топлення. Рідкі жири називають оліями. У складі твердих жирів переважають ацили насичених кислот, а рідких – ацили ненасичених кислот. Найбільш поширені з кислот містять від 12 до 18 атомів Карбону і мають нерозгалужені карбонові ланцюги з парним числом атомів Карбону. Виключення складають циклічні кислоти (хаульмугрова, стеркулова, гіднокарпова). З усіх кислот, що містяться в природних жирах найбільш поширена олеїнова кислота. Лінолева та ліноленова менш поширені. Слід зазначити, що лінолева та ліноленова кислоти не синтезуються в організмі тварин і людини і потрапляють тільки з їжею. Вони необхідні для синтезу простагландинів і тромбоксанів. Тому ці кислоти отримали назву незамінні карбонові кислоти. Основними джерелами цих кислот є конопляна, льняна, соняшникова, кукурудзяна олії, олія з насіння ріпаку. Недостатність в організмі лінолевої кислоти може привести до уповільнення зростання і змін в клітинах шкіри, залоз внутрішньої секреції і статевих органів. Недостатність ліноленової кислоти приводить до зниження здібності до навчання. Ненасичені кислоти з одним подвійним зв'язком зустрічаються в природі в цис-конфігурації. З декількома подвійними зв'язками частіше всього теж знаходяться в цис-(Z)-конфігурації. В 1990 роках з'явився ряд публікацій про шкідливість вживання транс-жирів, які утворюються при термічній обробці жирів і особливо гідрогенізації жирів (виробництво маргарину). З насичених пальмітинова кислота поширена майже як і олеїнова. Вона входить до складу всіх жирів, причому в деяких жирах вміст її становить 15-50% від загального вмісту всіх кислот. В меншій мірі поширені стеаринова та міристинова кислоти. Великий вміст їх (25% і більше) в овечому та яловичому запасних жирах і в олії тропічних рослин (масло какао). Як правило, якщо насичена кислота міститься в жирі у великій кількості, вона постійно супроводжується невеликими кількостями її вищих та нижчих гомологів. Так жир, головною складовою якого є пальмітинова кислота, містить також міристинову та стеаринову кислоти. Кількість будь-якої жирної кислоти може змінюватись в широких межах. Тому кислоти, що містяться в жирах, корисно розділити на дві категорії: головні та другорядні. Головні – це кислоти, вміст яких становить більше 10% від загальної маси жиру. Ця кількість може здаватися невеликою, але жири можуть містити до десяти і більше різних кислот. Природні жири можна класифікувати на основі кількості в них головних кислот. Така класифікація співпадає з класифікацією жирів за їх біологічним походженням. Другими словами, жири, що містяться в біологічно споріднених організмах, часто хімічно подібні. Крім того, в багатьох випадках другорядні кислоти можуть бути характерними для певної групи жирів. Наприклад, низькомолекулярні насичені кислоти (масляна) характерні для молока, або пальмітолеїнова – для жирів вищих наземних ссавців (вміст цієї кислоти 2 – 3%). Вміст ВКК в деяких оліях та жирах наведений в табл. 2. Таблиця 2. Вміст вищих карбонових кислот, що входять до складу жирів та олій
Знаючи жирнокислотний склад (табл. 2), наприклад, масла какао можна контролювати фальсифікації цього основного компоненту шоколаду (невідповідність складу ВКК або їх вмісту). Будова гліцеридів Природні жири, як правило, є повними естерами, тобто три гідроксила гліцерина етерифіковані трьома залишками вищих карбонових кислот. Такі повні естери гліцерину називають тригліцеридами. Однак зустрічаються і неповні естери, в яких залишок гліцерину зв’язаний лише з одним або двома залишками кислот (моно- і дигліцериди). Гідроксили гліцерина можуть бути етерифіковані або тільки однією кислотою (наприклад, пальмітиновою або олеїновою), або двома чи трьома різними ВКК. Наприклад, зустрічаються жири, які мають залишки двох або трьох різних кислот: · олеодистеарин, який має один залишок олеїнової кислоти і два залишки стеаринової кислоти; · олеопальмітостеарин – має залишки олеїнової, пальмітинової і стеаринової кислот.
Олеодистеарин Олеопальмітостеарин Тригліцериди які мають три залишки якої-небудь однієї кислоти, зустрічаються лише в небагатьох жирах або отримують синтетично. Жири, які мають залишки однакових кислот (R′ = R″ = R″′) – називають простими. Якщо ж залишки R′, R″, R″′ різні, то такі тригліцериди називають змішаними. Як уже зазначалося, більшість жирів містять дві чи три головні кислоти і ще деякі інші кислоти в межах кількості. Ці кислоти розподілені таким чином між молекулами гліцерида, щоб при цьому утворювалась по можливості більша кількість змішаних гліцеридів («принцип рівномірного розподілу»). Іншими словами, кожна молекула гліцериду прагне набути найбільш гетерогенний склад. Наприклад, оливкова олія, незважаючи на те, що вона містить дуже високий відсоток олеїнової кислоти (80% загальної кількості кислот), містить всього 30% триолеїна поряд з 45% діолеїнів з насиченими кислотами (пальмітинової і стеаринової) і 25% лінолеодіолеїнів. Склад масло какао: 55% – олеопальмітостеарин, 20% – олеодистеарин, тоді як трипальмітин, тристеарин та триолеїн міститься в незначних кількостях. Склад ялового жиру: 32% – олеопальмітостеарин, 23% – пальмітодіолеїн, 15% – олеодипальмітин, 11% – стеародиолеїн, 17% – гліцеридів насичених кислот (пальмітодистеарин, тристеарин). У природних тваринних тригліцеридах положення перше і третє зайняті переважно залишками насичених жирних кислот, а друге – ненасичених. У рослинних жирах може бути навпаки. Незважаючи на невеликий набір ВКК (5 – 8), що беруть участь в утворенні гліцеридів, значна кількість різних тригліцеридів пов'язана з різною будовою і положенням ацилів жирних кислот у молекулах тригліцеридів. Згідно з даними А.П. Нечаєва і Т.В. Єрьоменко ця загальна кількість має такий вигляд:
Ізомерія і номенклатура жирів Ізомерія тригліцеридів пов'язана з різним положенням 1,2,3-арилів у молекулі тригліцериду, їх будовою, положенням подвійного зв'язку, також можлива цис- та транс-ізомерія. Також має місце оптична ізомерія, яка зумовлена наявністю хірального (асиметричного) атома Карбону в положенні С2 , що трапляється в разі різних арилів у першого і третього атомів Карбону гліцерину. Естери гліцерину зазвичай називають гліцеридами або ж нумерують атоми Карбону гліцерину і зазначають положення замісників, добавляючи при цьому слово гліцерин. Наприклад, 1,2,3-тристеарат гліцерину, або 1,2-дистеарат-3-олеїноат гліцерину. Оскільки жири – естери вищих жирних кислот і пропантріолу, то систематичну назву можна побудовати за принципом назв естерів:
Пропантриїл-1,2-дигексадеканоат-3-октадецен-9-оат (IUPAC) або 1,2-дипальмітат-3-олеїноат гліцерину (олеодіпальмітат). Фізичні властивості Тригліцериди – тверді або рідкі речовини без смаку, запаху і кольору, з низькими температурами топлення і високими температурами кипіння. Завдяки високим температурам кипіння на них можна жарити їжу і жири не випарюються зі сковороди. Температура топлення залежить від типу кислот, які входять до складу. У гліцеридів спостерігається дивне явище «подвійного топлення». Так, чистий тристеарин топиться при 71°С. Однак, якщо тристеарин розтопити, а потім охолодити, то при повторному нагріванні він плавиться спочатку при 55°С, потім твердне і знову топиться при 71°С. Це явище обумовлено наявністю трьох поліморфних кристалічних форм. Оскільки природні жири – суміш змішаних триацилгліцеридів, вони топляться за різних температур в широкому інтервалі. Тваринні жири (яловичий, баранячий, свинячий) – тверді, вони містять в основному залишки насичених кислот (пальмітинової і стеаринової). Рослинні жири (олії) – рідини, молекули яких містять переважно залишки ненасичених кислот (олеїнової, лінолевої, ліноленової) та деяких інших. Консистенція жирів, тобто ступінь їх густини або м’якості залежить від співвідношення насичених і ненасичених кислот, які входять до складу жирів. Жири майже не розчинні у воді, спирті, можуть утворювати колоїдні дисперсії та емульсії, які стабілізуються в присутності ПАР (емульгаторів): білків, мила, сульфокислот. Жири дуже мало розчинні у воді. Але добре розчинні в діетиловому та петролейному етерах. Вони легші за воду (r= 0,91). Для хімічної характеристики жирів використовуютьтак звані числа, які визначаються аналітичним шляхом: число омилення, йодне число та кислотне число. Число омилення (ЧО) – це число міліграмів калій гідроксиду (КОН), затраченого на нейтралізацію жирних кислот при омиленні 1 г жиру. Чим нижче число омилення, тим більша молекулярна маса жирних кислот, які входять до складу цього жиру, і навпаки, чим вище число омилення, тим менша молекулярна маса кислот, які входять до складу жиру. У рапсової олії ЧО дорівнює – 172 – 174 (високомолекулярні кислоти), ЧО триолеїну (С18) – 192, коров'ячого жиру – 226, кокосової олії – 246 (низькомолекулярні кислоти). Йодне число (ЙЧ) є показником ненасиченостіжиру. Йодне число – це кількість грамів йоду, який приєднується (за місцем подвійних зв'язків) до 100 г жиру. Чим вище йодне число – тим більш ненасиченим є даний жир, тим більше подвійних зв’язків міститься в жирних кислотах. Приєднання йоду не відбувається кількісно, тому йодне число має умовне значення і використовується для оцінки якості висихаючих олій (використовуються при виробництві оліфи для приготування фарб) – значення більше 130. Йодне число лляного масла дорівнює 170 – 180. Йодні числа невисихаючих олій менші 90 (оливкова олія – 75 – 88). Соняшникова олія напіввисихаюча – 127 – 136. Кислотним числом (КЧ) називається показник, який характеризує кількість вільних жирних кислот в жирі. Кислотне число виражається в міліграмах калій гідроксиду, витраченого на нейтралізацію вільних жирних кислот, які містяться в 1 г жиру. По значенню кислотного числа, можна визначити якість жиру. Хімічні властивості Характерні реакції естерів, але мають певні особливості. 1. Гідроліз, або омилення – найважливіша реакція, яка відбувається під впливом кислот, лугів, ферментів. а) омилення лугами:
Жир Гліцерин Мило Солі лужних металів називають милами, внаслідок чого утворилися терміни «омилення» і «реакція омилення», що відповідають сучасному терміну «гідроліз».
Тверде мило Рідке мило Коли лужний гідроліз жирів потрібно прискорити, його проводять в спиртовому розчині, а не у воді. б) омилення водою:
Жир Гліцерин Кислоти Продуктами омилення водою, є вільні жирні кислоти (не розчинні у воді) та гліцерин. У тваринних і рослинних організмах гідроліз жирів відбувається під дією ферменту – ліпази. Продукти гідролізу всмоктуються у вигляді вищих жирних кислот та гліцерину. Жири – енергетично дуже цінні продукти харчування. Загалом жири вважаються висококалорійними продуктами, зловживати якими недоцільно. При засвоєнні 1 г жиру виділяється 38,8кДж (9,3кКал). За рахунок жирів забезпечується 25 – 35% добової потреби людини в енергії. Рекомендована норма жиру в раціоні людини 90 – 107 г на добу. Недостатність жирів у харчуванні або систематичне використання продуктів зі зниженим вмістом жирів приводить до порушення роботи нервової системи, зниження імунітету. Проте надлишкове вживання жирів теж небажане – викликає ожиріння, виникають серцево-судинні захворювання. Для омилення жирів в промисловості використовують насіння рицини, яке містить багато ліпази. Гідролітичний розпад жирів та олій, ліпідів зерна та продуктів його переробки, м'яса, риби є однією з причин погіршення їх якості та псування. Цей процес прискорюється із збільшенням вологості продуктів, що зберігаються, підвищенням температури, активності ферменту ліпази. Гідроліз відбувається у багатьох технологічних процесах та під час кулінарної обробки продуктів (під час варіння та жарки). Продукт гідролізу – гліцерин перетворюється на шкідливий для здоров'я людини акролеїн в результаті дегідратації:
Акролеїн Акролеїн має різкий неприємний запах, викликає сльозовиділення. Кількість вільних жирних кислот, які містяться у продуктах і утворюються при гідролізі жирів, визначається кислотним числом. 2. Переестерифікація Гліцериди за наявності каталізаторів (луги, метилат натрію, етилат натрію, натрій, калій) здатні обмінюватися ацилами як міжмолекулярно так і внутрішньомолекулярно. Реакція міжмолекулярної переестерифікації:
Реакція внутрішньомолекулярної переестерифікації:
Переестерифікація приводить до зміни фізико-хімічних властивостей жирів і олій і дозволяє одержувати жири з необхідними для харчової технології властивостями без зміни їх жирнокислотного складу. Переестерифіковані жири використовуються в харчовій промисловості для одержання аналогів молочного жиру, кондитерського жиру, комбінованих жирів або продуктів з заданими властивостями. 3. Алкоголіз Гліцериди під час нагрівання зі спиртами за наявності каталізаторів (луги, алкоголяти лужних металів, сульфатна кислота) утворюють естери відповідної кислоти і спирту. При цьому вивільнюється гліцерин. Такий обмін спиртів у естерах називають алкоголізом.
Жир Гліцерин Кислоти Зі збільшенням молекулярної маси спирту алкоголіз уповільнюється. Наприклад, для соняшникової олії з використанням етилового спирту (С2Н5ОН) перебіг процесу алкоголізу досягає 35,3%, а з використанням амілового спирту (С5Н11ОН) – 11,5%. Положення рівноваги можливо здвинути зі зміною співвідношення тригліцеридів і спирту (використання надлишків), або виведенням із зони реакції одного із продуктів (наприклад, гліцерину) реакції. 4. Ацидоліз Під час нагрівання до 250 – 300°С тригліцеридів з жирними кислотами за наявністю каталізаторів (сульфатна кислота, бор трифлуорид) відбувається обмін ацилів (R1 на R):
Алкоголіз і ацидоліз – окремі випадки реакції переестерифікації. Ці реакції зумовлені наявністю в молекулах гліцеридів естерних груп. 5. Гідрогенізація жирів Не менш важливі для практики реакції, які відбуваються з перетворенням вуглеводневих залишків. До таких реакцій належать реакції гідрогенізації (або гідрування) гліцеридів. Гідрогенізація жирів – це процес приєднання водню до залишків ненасичених кислот, які входять до складу жирів, в результаті чого ці залишки переходять в залишки насичених кислот. А жири при цьому з рідких перетворюються на тверді. Вперше гідрогенізацію жирів здійснив С. Фокін у 1906 році. Найчастіше гідрують соняшникову, соєву, арахісову олії. Гідрування приводить до зміни жирнокислотного складу жирів та олій і дозволяє одержати продукт із більшою температурою топлення, твердістю, стійкістю до окиснення, пластичністю. Реакцію здійснюють воднем під час нагрівання до 180 – 240°С за наявності каталізаторів (подрібнений нікель). Змінюючи відповідно умови реакції, можливо здійснювати гідрування селективно, тобто гідру вати спочатку залишки ліноленової кислоти, потім лінолевої і, якщо треба – олеїнової кислоти.
1-Олеїноїл-2-лінолеїл-3-ліноленоїл Тристеароїл, три стеарин (Рідкий жир) (Твердий жир) Продукт реакції називається саломасою («штучним салом») і служить основою для виготовлення маргарину, інших харчових жирів, застосовується у виробництві мила. Для виготовлення маргарину саломасу емульгують у молоці, попередньо обробленому бактеріями Bacillus aidi levolactiti, які продукують молочну кислоту. Далі до утвореної емульсії додають для кольору каротин або яєчний жовток, для запаху вершкового масла – бутандіон, для запобігання окисненню – антиоксиданти на зразок 2-трет-бутил-4-метоксифенолу, лецитин (природний ПАР), сіль, цукор, вітаміни D тощо. При неповному гідруванні отриманий саломас застосовується для виготовлення м'яких сортів маргарину. Необхідно зауважити, що існує думка про певну шкідливість гідрованих рослинних олій для людини. Систематичне вживання таких жирів та продуктів на їхній основі (печиво – до 30 – 50% транс-ізомерів, картопля фрі – близько 40%, чіпси – 30% тощо) збільшують ризик ішемічних захворювань на серце, мозок; сприяють іншим видам атеросклерозу. Це пов'язують з появою в таких оліях (жирах) транс-карбонових кислот. Останні виникають в жорстких умовах процесу гідрування внаслідок ізомеризації цис-конфігурації, яка здебільшого притаманна природним ненасиченим кислотам. Кількість транс-карбонових кислот у кінцевому продукті може досягати 15 – 20% від суміші всіх ВКК. 6. Окиснення жирів Під впливом світла і кисню повітря, а також при дії води у жирів з’являється неприємний смак і запах. Цей процес окиснення і часткового гідролізу називають згірклістю жирів. Ненасичені кислоти окиснюються в місці подвійних зв'язків, утворюючи пероксидні сполуки. Надалі відбувається розрив карбонового ланцюга за місцем подвійного зв'язку, у результаті чого утворюються альдегіди і кислоти з коротким ланцюгом, типу масляної кислоти з неприємним запахом. Ці продукти перетворень надають жиру гіркого присмаку. Механізм окиснення жирів, розкритий М. Семьоновим, оснований на пероксидній теорії Баха і Енглера. На першій стадії окиснюється переважно група –СН2–, яка розташована в α-положенні відносно подвійного зв'язку. В результаті гемолітичного розриву зв'язку між Гідрогеном і Карбоном в α-положенні утворюється радикал, який при взаємодії з киснем повітря утворює пероксидний радикал. Після взаємодії цього радикалу з новою молекулою жиру утворюються гідро пероксид і новий радикал.
Первинні продукти окиснення жирів – гідропероксиди. Це нестійкі сполуки, вони перетворюються на вторинні продукти окиснення жирів –епоксисполуки, кетони, альдегіди, спирти та їх похідні. Під час утворення вторинних продуктів окиснення може відбуватися розрив карбонового ланцюга.
В результаті полімеризації та поліконденсації продуктів окиснення відбувається так зване «зшивання» молекул і обрив ланцюга, що приводить до утворення низькомолекулярних сполук. Швидкість реакції окисненнязростає зі збільшенням: ступеня ненасиченості ВКК, які входять до складу жиру; рівня вологості; температури та вмісту кисню; присутності іонів металів (заліза, марганцю, міді). Надзвичайно великий вплив на швидкість окиснення має присутність антиоксидантів – речовин, що утворюють з вільними радикалами стабільні сполуки. До природних антиоксидантів відносяться токофероли, сполуки фенольної природи – кварцетин. Активність антиоксидантів зростає в присутності їх синергістів, зокрема, лимонної та аскорбінової кислот, лецитину. В тваринному організмі кислоти жирів окиснюються до диоксиду вуглецю і води. На сьогодні відомі всі проміжні стадії цього складного процесу. Окиснення починається з –СН2– групи, що знаходиться в β-положенні відносно карбоксильної групи (–СООН). β-кетокислота, яка при цьому утворюється, розкладається в результаті гідролізу з утворенням нової кислоти і оцтової кислоти. RCH2CH2COOH → R-COCH2COOH + H2O → R-COOH + CH3COOH Щойно утворена кислота підлягає подібному окисненню до тих пір, поки не утвориться ацетооцтова кислота СН3СОСН2СООН. Остання окиснюється в тканинах (головним чином в м'язах) до СО2 і H2O. Воски До простих ліпідів відносяться воски – жироподібні аморфні речовини з температурою топлення 36 – 90 оС. За хімічною природою це естери вищих карбонових кислот і вищих спиртів, які здебільшого мають парну кількість атомів Карбону (табл.3). Крім згаданих естерів, у воску містяться вільні ВКК і ВС, алкани та інші домішки. Завдяки тому, що до складу восків входять головним чином насичені ВКК і спирти, воски в хімічному відношенні достатньо інертні речовини і важко окиснюються киснем повітря. Воски важко гідролізуються. Таблиця 3. Вищі спирти
Більшість восків – тверді, пружньопластичні, інколи за кімнатної температури навіть крихкі речовини. Тільки деякі воски мають за кімнатної температури рідку консистенцію. Воски широко розповсюджені у природі. У рослин вони вкривають тонким шаром листя, стеблі, плоди і оберігають їх від змочування водою, висихання та дії мікроорганізмів. Бджолиний віск оберігає мед, личинок бджіл. Ланолін – тваринний віск – оберігає волосся і шкіру від дії води. У фітопланктону воски виконують функцію клітинного палива. За походженням воски поділяють на тваринні (бджолиний, ланолін, спермацет), рослинні (карнаубський, лляний) і викопні (монтанний). Тваринні воски Це бджолиний, який виділяють своїми залозами бджоли; вовняний, який накопичується в відносно великих кількостях в вовні овець; спермацетове масло і спермацет, який в свою чергу міститься в полостях черепної коробки кашалота. Бджолиний віск містить до 72% естерів здебільшого церилового та мірицилового спиртів пальмітинової, церотинової, меліси нової кислот, з яких мірицилпальмітат С15Н31СООС30Н61 складає 33%, вільних ВКК – 13%, алканів до 12%. Температура топлення становить 62 – 70оС, ЧО = 85 – 107; КЧ = 18 – 22. Віск важко гідролізується спиртовим розчином КОН. Бджолиний віск застосовується як компонент полірувальних засобів та лікарських препаратів. Ланолін (від грецьк. lana – вовна, oleum – олія) добувають з жиропоту овець (на овечій вовні вміст такого воску досягає 25%). Це світло-жовта речовина зі слабким специфічним запахом, температура топлення становить 36 – 42оС. За хімічним складом це суміш естерів цетилового, церилового спиртів, а також, на відміну від інших восків, холестерину та його гідроксипохідних, з міристиновою, пальмітиновою, церотиновою кислотами. Характерним для ланоліну є вміст церотино-церилового естеру С25Н51СООС26Н53.
Холестерин Ланолін стійкий до окиснення, на відміну від інших восків утворює стійкі водні емульсії. Завдяки цьому його використовують як мазеву та кремову основу, до якої вводять водорозчинні лікарські препарати. Спермацет (від грецьк. sperma – сім'я, ketos – морська тварина) міститься в черепній порожнині (спермацетовому мішку) кашалота. Він на 98% складається з цетилпальмітату С15Н31СООС16Н33 (цетиловий естер пальмітинової кислоти). Температура топлення становить 45 – 54оС. Запах специфічний, дещо нагадує запах ворвані. Використовують як кремову та мазеву основу у парфумерії, як фармацевтичні препарати для лікування хронічних виразок. Рослинні воски Карнаубський віск покриває листя бразильської воскової пальми Copernicia cerifera. Він містить до 80% естери мірицилового спирту з карнаубовою С23Н47СООН і церотиновою кислотами; інших естерів ВКК С16 – С28 і ВС С30 – С32; вільних ВС (переважно монтанового). Карнаубський віск – тверда, крихка маса, яку можна розтерти в порошок. Колір її від сіровато-жовтого до зеленувато-жовтого. Температура топлення становить 83 – 91оС. Використовують у кондитерській промисловості для надання глянцю шоколадним та цукровим драже. Лляний віск, який покриває стеблини льону, містить приблизно 35% естерів церилового спирту з олеїновою, ліноленовою, пальмітиновою і стеариновою кислотами. Викопні воски Крім тваринних і рослинних восків, відомий також монтановий (буровугільний) віск – мінеральний викопний продукт. Його виділяють із бурого вугілля (або з торфу) екстракцією бензином або бензино-бензеновою сумішшю при нагріванні. Такий неочищений віск складається приблизно із власне монтанового воску 70%, смоли 20% і асфальтенів 10%. Хімічний склад є сумішшю вільних ВКК (С24 – С30) головним чином монтанової, їхніх естерів з ВС (С24 – С30), вільних ВС, алканів тощо. З метою очищення сирого монтанового воску проводять його знесмолення. Монтанового віск з температура топлення 77 – 87оС широко використовується як мастила, полірувальні пасти і креми. СКЛАДНІ ЛІПІДИ До складних ліпідів відносяться речовини, молекули яких крім залишків жирних кислот і спиртів містять також похідні ортофосфатної кислоти (фосфоліпіди), залишки вуглеводів (гліколіпіди), азотисті сполуки – холін, коламін, серін. Складні ліпіди містяться майже у всіх тканинах людського і тваринного організму, переважно у клітинних мембранах, особливо у мозкової і нервовій тканинах. Фосфоліпіди Фосфоліпіди (фосфатиди) – ліпіди, які при гідролізі крім гліцерину і вищих жирних кислот дають фосфатну кислоту і аміноспирт. Фосфоліпіди розділяються на два класи: лецитини і кефаліни (цефаліни), які відрізняються аміноспиртом. Лецитини (від грецьк. lethitos – жовток) містять холін НО-СН2-СН2-N+(CH3)3. Кефаліни містять коламін (етаноламін) НО-СН2-СН2-NН2, а також серин – Лецитини (фосфатидилхоліни) вперше були виділені в 1845 р. з яєчного жовтка. Вони також містяться у печінці, серцевому м'язі. Особливо багато їх в рослинних продуктах – насінні олійних культур, гороху, злаків. За хімічною будовою вони є діацилгліцерофосфатами, в яких фосфатна група додатково естерифікована холіном.
(фосфатидилхолін) (фосфатидилетаноламін)
В утворенні молекул фосфатидилхолінів беруть участь як насичені так і ненасичені вищі жирні кислоти. В більшості випадків до складу лецитинів входить один залишок насиченої і один залишок ненасиченої жирних кислот (здебільшого С16 – С22). Лецитини добувають із природних джерел послідовними екстракцією ліпідів, виділенням фракційним осадженням та хроматографічним розділенням на силікагелі. Лецитини розчинні в спирті і етері, кефаліни – тільки в етері. Кефаліни – суміш фосфатидилетаноламінів із фосфатидилсеринами. До складу здебільшого входить стеаринова і олеїнова кислоти. На прикладі фосфатидилетаноламіну можна прослідкувати за його гідролізом, який відбувається аналогічно і для інших складних ліпідів:
У результаті повного гідролізу утворюється суміш гліцерину, стеарату та олеату натрію, етанол амін і фосфат натрію. Фосфатиди є поверхнево-активними речовинами. В молекулі міститься гідрофільний (полярний) фрагмент, який називається «головкою», і гідрофобний (неполярний) – «хвіст». До «головки» належать залишки карбоксильної групи карбонових кислот, азотовмісної складової та фосфатної кислоти, а до «хвоста» – залишки аліфатичної частини ВКК. Тому фосфоліпіди є амфифілами (мають спорідненість як до полярних розчинників, так і до неполярних).
Гідрофобний «хвіст» Полярна «головка» В неполярних розчинниках молекули фосфоліпідів утворюють міцели, у яких гідрофобні частини складають зовнішній шар, а гідрофільні – внутрішній. В полярних розчинниках – навпаки. Структуру міцел у розчинниках різної природи можна представити так:
Завдяки амфифільній природі фосфоліпіди можуть утворювати емульсії. Використовуються як емульгатори у хлібопекарному та кондитерському виробництві і для одержання маргаринової продукції. Гліколіпіди Гліколіпіди – сполуки, що містять залишки вуглеводів, сполучених із ліпідною основою. Виконують структурні функції, приймають участь у побудові мембран, їм належить важлива роль у формуванні клейковин них білків пшениці, які визначають хлібопекарну якість борошна. Гліколіпіди розділяють на дві основні групи: цереброзиди і гангліозиди. В молекулах гліколіпідів роль полярного компоненту виконує не фосфат, а залишок вуглеводу (галактози, глюкози, манози або олігосахариду), з'єднаний з центральною ланкою етерним зв'язком. На відміну від гліцерофосфоліпідів, побудованих на основі гліцерину, центральною ланкою може бути двоатомний аміноспирт сфінгозин з 18 атомами Карбону:
Цереброзиди в значній кількості містяться в головному мозку, де виконують важливу структурну і метаболічну функції в мембранах нервових клітин. Вуглеводним компонентом їх є D-галактоза або D-глюкоза; аміноспирт– сфінгозин; нервонова (С24), церебронова СН3-(СН2)12СН(ОН)СООН, лігноцеринова кислоти. Залишок сфінгозину
Галактоцереброзид (нервон) До складу галактоцереброзиду (1/-β-D-галактопіранозил-N-нервоноїлсфінгозину) входить нервонова кислота, сполучена амідним зв'язком із сфінгозином, і β-D-галактоза, приєднана β-глікозидним зв'язком до гідроксилу сфінгозину при С1. Цереброзиди – тверді речовини, що не розчиняються у воді, але розчиняються в органічних розчинниках. При кислотному гідролізі розщеплюються на складові: сфінгозини, ВКК і моносахариди. Цереброзиди використовуються як діагностичні біопрепарати. Гангліозиди містяться переважно в сірій речовині мозку, у мембранах нервових тканин і беруть участь у регуляції росту і адгезії тканин, передачі нервових імпульсів, імунологічних процесах тощо. У структурному відношенні гангліозиди подібні до цереброзидів, відрізняються тим, що замість моносахариду вони містять складний олігосахарид, до складу якого входить принаймні один залишок N-ацетилнейраміновой (сіалової) кислоти:
Піранозна форма N-ацетилнейрамінова (сіалова) кислота
Одним з найпростіших представників гангліозидів є гематозид, який виділено із строми еритроцитів. Галактоза Глюкоза Сфінгозин
ВІТАМІНИ Вітаміни– група низькомолекулярних органічних сполук відносно нескладної будови і різної хімічної природи. Це група природних органічних сполук, об'єднаних властивостями абсолютної необхідності їх для гетеротрофного організму, в якості складової частини продуктів споживання. Вітаміни містяться в цих продуктах в дуже малих кількостях, і тому відносяться до мікронутрієнтів. Вітаміни (від латинської νita –«життя») – сполуки, які необхідні організму для нормальної життєдіяльності. Вони є складовою частиною харчів, необхідних організму у невеликій кількості і приймають участь в багатьох біохімічних реакціях, виконуючи каталітичну функцію в складі активних центрів багатьох різних ферментів або виступають інформаційними регулюючими посередниками, виконуючи сигнальні функції екзогенних прогормонів і гормонів. Концентрація вітамінів в тканинах і добова потреба в них невелика, але при недостачі надходження вітамінів в організм наступають характерні і небезпечні патологічні зміни. Більшість вітамінів не синтезуються в організмі людини і тварини. Тому вони регулярно і в достатній кількості повинні надходити в організм з продуктами харчування або у вигляді вітаміно-мінеральних
Поиск по сайту: |
 перешкоджає асоціації двох амілоз них молекул і довгих бічних ланцюгів амілопектину.
перешкоджає асоціації двох амілоз них молекул і довгих бічних ланцюгів амілопектину.


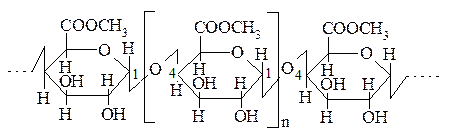











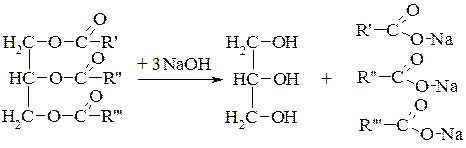



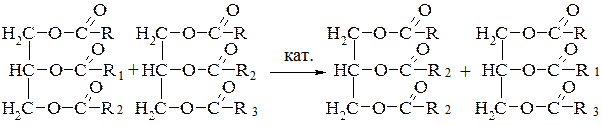





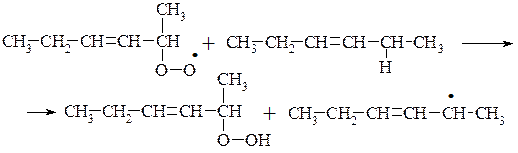





 Лецитин Кефалін
Лецитин Кефалін





 Гематозид
Гематозид