 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Послідовність виконання експерименту
Готується одна з реакційних сумішей, вказаних у табл. 4.5.
Таблиця 4.5 Об'єми вихідних розчинів для приготування реакційних сумішей (визначення загального порядку)
Момент вливання 0,1 М розчину йодиду калію у реакційну суміш вважають за початок реакції. Додають декілька крапель 1%-ного розчину крохмалю й проводять експеримент, як це описано вище у розділі "Визначення частинних порядків реакції". Виконують 8-10 титрувань. Результати записують у табл. 4.3. Обробка результатів експерименту Загальний порядок реакції може бути обчислений за повною кінетичною кривою CFe3+= f(t) (рис. 4.4).
Щоб обчислити концентрації FeCl3 у дану мить реакції треба від його вихідної концентрації у реак-ційній суміші відняти концентрацію феруму (III), що прореагував до даного моменту часу:
де CX – змен-шення концентрації FeCl3 до моменту часу t. Слід врахувати, що у відповідності до рівняння реакції CX = 2CI2. Результати розрахунків записують у таблицю 4.3. Швидкості реакції у кожний даний момент часу знаходять методом кінцевих різниць. Для цього вісь часу розбивають на рівні проміжки (наприклад, по 30 с), для кожного знаходять концентрацію Fe3+ за кінетичною кривою. Швидкість обчислюють за формулами
де
Виконують 7-8 розрахунків, результати записують у таблицю 4.4. Будують графік залежності lnwt = f(lnCt) (4.9), за тангенсом кута нахилу якої знаходять загальний порядок реакції. Результати обчислень оформити у вигляді таблиці. Контрольні питання 1. Що називається загальним і частинним порядками реакції? 2. Як визначається швидкість реакції за кінетичною кривою? 3. Назвіть методи визначення порядку реакції. 4. Поясніть суть визначення частинних порядків реакції диференційним методом Вант-Гоффа. 5. У чому полягає "метод внутрішнього титрування" для вивчення кінетики реакцій у розчинах? 6. Які експериментальні дані необхідні для визначення загального порядку досліджуваної реакції? 7. У чому полягають особливості кінетики даної реакції? Який її механізм? 8. Як впливає іонна сила розчину на швидкість реакції окислення йодид-іонів іонами тривалентного феруму? Аргументуйте відповідь.
Лабораторна робота № 5
Поиск по сайту: |
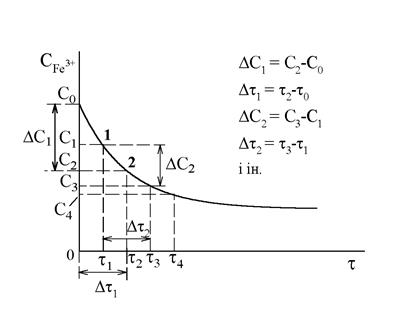 Рис. 4.4. Кінетична крива CFe3+= f(t)
Рис. 4.4. Кінетична крива CFe3+= f(t)
 , (4.10)
, (4.10) ; і ін., (4.11)
; і ін., (4.11) ;
; ;
; ;
; і т.д. (див. рис. 4.4).
і т.д. (див. рис. 4.4).