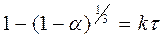|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Растворимость газов в расплавленных металлах⇐ ПредыдущаяСтр 22 из 22
Газы растворяются в расплавленных металлах по механизму, существенно отличающемуся от механизма растворения в воде. В воде газы растворяются в молекулярном состоянии, а в расплавленных металлах они растворяются в атомном состоянии. В случае растворении газа в расплавленном металле закон Генри не применим. Сивертс (1911г.) провел обширные исследования по изучению влияния давления на растворимость и нашел, что для двухатомных газов растворимость пропорциональна корню квадратному из давления газа. Эта зависимость стала известна как закон Сивертса. Он объяснил это явление допустив, что газ диссоциирует перед абсорбцией. Например, растворимость азота в металлах может быть выражена следующими уравнениями: N2(г) Û 2N(в металле),
Следовательно, Растворенные газы сильно влияют на свойства металлов при их плавлении и литье. Выделение растворенных газов во время затвердевания приводит к образованию пустот и трещин в литом металле. Затвердевший металл еще сохраняет следы газа, которые влияют на свойства металла. Для удаления газов из металлов применяют вакуумную плавку.
Лекция 17
КИНЕТИКА РАСТВОРЕНИЯ Физические процессы Растворение твердых веществ в воде изучалось впервые Щукаревым (1896г.) и Нойесом и Уитни (1897г.) методом вращения таблеток, спрессованных из порошка с последующим анализом раствора через определенные промежутки времени. Они нашли, что скорость увеличения концентрации растворенного вещества соответствует уравнению
где С- концентрация растворенного вещества в момент t; СТ – растворимость соединения в воде при температуре эксперимента, и k – константа скорости. После интегрирования этого уравнения получаем:
т.е. графическая зависимость lg CT/C – C от t представляет собой прямую линию. Найденная зависимость подтверждает, что на поверхности раздела быстро образуется насыщенный слой и наблюдаемая скорость растворения является скоростью, с которой сольватированные молекулы диффундируют из этого слоя по всему объему раствора. В более поздних экспериментах в уравнение (185) была включена площадь поверхности:
Химические процессы В 1904г. Нернст распространил уравнение физических процессов на химические процессы. Можно считать, что химическая реакция происходит следующим образом. Когда кристалл погружают в кислоту, его поверхность быстро покрывается насыщенным слоем продуктов реакции. Чтобы достичь поверхности кристалла, кислота должна диффундировать через пограничный слой. Скорость растворения кристалла будет определяться скоростью диффузии кислоты через слой Нернста. Используя закон диффузии Фика было установлено соотношение между константой k| в уравнении (187) и коэффициентом диффузии раствора
Подставляя значение k в уравнение скорости, получаем
где D – коэффициент диффузии кислоты; F – площадь поверхности твердого вещества; V – объем раствора; С – концентрация кислоты в объеме раствора; Ci – концентрация кислоты на поверхности раздела фаз; d - толщина диффузионного слоя. В общем случае при Ci ¹ 0 скорость диффузии может быть равна скорости химической реакции на поверхности раздела фаз;
Скорость растворения будет равна
Если D/d << k , то скорость равна (D/d)FC, т.е. процесс контролируется диффузией, а если k<< D/d, w = kFC, т.е. процесс контролируется скоростью химической реакции.
Реакции порошкообразных веществ Уравнения скорости, выведенные ранее, можно использовать, когда площадь поверхности реагирующего твердого вещества постоянна. Если реагирующее твердое вещество представляет собой порошок с частицами одинаковых размеров (сферы), то площадь поверхности будет уменьшаться со временем, и скорость будет описываться соотношением
Изменение массы порошка UO2 во времени при растворении в смеси карбоната-бикарбоната натрия в присутствии кислорода по реакции UO2 + 2CO32- +1/2 O2 +H2O ® [UO2(CO3)2]2- + 2OH- Определенное Шортманом и Де-Сеса (1958г.) показаны на рисунке [1] Силикогели и алюмогели: МСМ – мелкий силикогель молотый. Удельная площадь поверхности – 580 м2/г. Радиус пор 13Ао. Применяется для осушки воздуха, газов от легко конденсирующихся паров и газов. Синтетические цеолиты. Типы А и Х – алюмосиликагели – молекулярно-ситовое действие. Высокая адсорбционная способность – глубокая осушка и тонкая очистка газов и жидкостей.
Поиск по сайту: |
 , (184)
, (184) , т.е. концентрация азота в жидком металле при равновесии пропорциональна корню квадратному от давления азота.
, т.е. концентрация азота в жидком металле при равновесии пропорциональна корню квадратному от давления азота.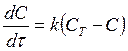 (185)
(185)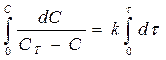 ,
, 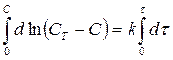 ,
,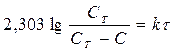 (186)
(186)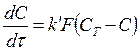 (187)
(187)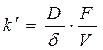 (188)
(188)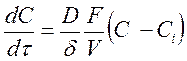 (189)
(189)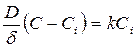 (190)
(190)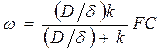 (191)
(191)