 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
АДСОРБЦИОННО-ХИМИЧЕСКИЕ СТАДИИ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
В процессе становления и развития технологии производства гексафторида урана, для утилизации остатков (следов) фтора, гексафторида урана, фтористого водорода применялись различные сорбенты. Лучше всех зарекомендовали себя: фтористый натрий, фтористый кальций, активированный уголь. В этом случае для извлечения полезных продуктов из так называемых «хвостов» используется процесс адсорбции. Под адсорбцией принято понимать концентрирование газообразных веществ (адсорбатов) на поверхности твердых веществ (сорбентов). Количество адсорбируемого вещества зависит от давления или концентрации этого вещества. Чем выше давление или концентрация тем больше количество адсорбируемого вещества. Если сорбент находится в постоянном соприкосновении с газом или раствором, то количество адсорбируемого вещества возрастает, а концентрация окружающих его молекул убывает до тех пор пока скорость десорбции не станет равной скорости адсорбции, т.е. пока не установится адсорбционное равновесие. Если концентрация газа увеличивается, то количество адсорбируемого вещества возрастает до нового равновесного значения. Если концентрация газа уменьшается, то сорбент будет отдавать адсорбированное вещество среде, пока вновь не установится адсорбционное равновесие. В общем случае речь идет об установлении динамического равновесия между молекулами адсорбента на поверхности и в объеме газовой фазы. Существуют два вида адсорбции – физическая и химическая. Главное их отличие состоит в природе сил, которые их вызывают. Природа сил вызывающих физическую адсорбцию, аналогична природе сил, которые вызывают конденсацию пара с образованием жидкости. Такие силы называют Ван-дер-ваальсовскими. Теплота, выделяющаяся в процессе физической адсорбции имеет тот же порядок, что и теплота конденсации пара (~ 10 – 40 кДж/моль). Как правило. Физическая адсорбция играет существенную роль тогда, когда температура газа понижается ниже критической, т.е. когда газ находится в виде пара. Физическая адсорбция сопровождается капиллярной конденсацией, т.е. переходом пара в жидкость при давлениях, меньших давления насыщенного пара. Сущность капиллярной конденсации в узких капиллярах, если жидкость смачивает их стенки, мениск всегда бывает вогнутым. В этом случае давление насыщенного пара (Рнас ) будет более низким чем над плоской поверхностью.
Давление насыщенного пара над плоской поверхностью всегда меньше, чем давление насыщенного пара над выпуклой поверхностью. В результате пар, еще не достигший давления насыщения по отношению к плоской поверхности, может быть уже насыщенным (перенасыщенным) по отношению к жидкой фазе, находящейся в тонком капилляре и конденсироваться в них постепенно заполняя его (капиллярная конденсация). При наличие капиллярной конденсации изотерма адсорбции при приближении к Рнас имеет изгиб вверх.
Давление пара Рнас Рисунок 33. Зависимость скорости адсорбции от давления пара. Положение кривой зависит от характера пор адсорбента. Поэтому такой вид кривой адсорбции характерен для очень пористых веществ – активированного угля, цеолитов, силикагеля и т.д.[1] Количество адсорбированного газа при физической адсорбции при Р = const уменьшается с повышением температуры и зависит от природы газа. Так с повышением температуры сжижения газа количество адсорбирующегося газа увеличивается. Однако скорость процесса физической адсорбции мало зависит от температуры, т.к. определяется скоростью диффузии. Энергия активации физической адсорбции мала – от 1 до 5 ккал/моль. ЛЕКЦИЯ 13 Хемосорбция
Хемосорбция может протекать при температурах выше и ниже критической температуры адсорбируемого газа. От физической адсорбции ее отличает прежде всего зависимость от химической природы адсорбента и адсорбата. Теплоты хемосорбции близки к теплотам химических реакций. Хемосорбированные вещества удалить с поверхности сорбента значительно труднее, чем при физической адсорбции, причем десорбция может сопровождаться химическими реакциями. Например, при термической десорбции кислорода с угля (кислород хемосорбируется на угле очень прочно) вместо кислорода выделяется смесь CO и CO2. При хемосорбции количество адсорбируемого вещества также уменьшается с повышением температуры, но обычно количество хемосорбированного вещества больше, чем при физической адсорбции. Скорость процесса хемосорбции существенно зависит от температуры- растет по экспоненте с повышением температуры. Энергия активации хемосорбции достигает несколько 10-ов ккал/моль. Хемосорбция нередко протекает сравнительно медленно. Со скоростью, определяемой наличием активационного барьера (отсюда название «активационная адсорбция»). При хемосорбции молекулы или атомы адсорбента обмениваются электронами, образуя поверхностное химическое соединение. В этом случае действуют гораздо большие (валентные) силы, чем Ван-дер-ваальсовские. Очень часто для одного и того же вещества, но в различных интервалах температур можно наблюдать оба типа адсорбции. При низких температурах наблюдается физическая адсорбция, при высоких – хемосорбция. Оба процесса разделены промежуточной областью, которая характеризуется увеличением количества адсорбированного вещества.
-100 0 100 200 300 Т, 0С Рисунок 34. Количество адсорбированного водорода на магний-хромистом катализаторе в зависимости от температуры. Отличие физической и активированной адсорбций сказывается в различии длины связи адсорбированных частиц с атомом или молекулой на поверхности адсорбента. При хемосорбции длина связи гораздо меньше длины связи в случае физической адсорбции и составляет величину того же порядка, что наблюдается в случае больших химических соединений. В некоторых случаях хемосорбция является одной из стадий гетерогенного процесса. Предполагают, что хемосорбция приводит к деформации адсорбированных молекул и тем самым повышает их реакционную способность. При физической адсорбции происходит образование множества слоев адсорбируемого вещества, хемосорбция характеризуется образованием мономолекулярного слоя.
Поиск по сайту: |
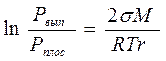 формула Томпсона (137)
формула Томпсона (137)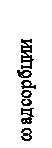

 250
250
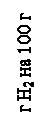
 50
50