 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
МЕХАНИЗМ ХИМИЧЕСКИХ РЕАКЦИЙ⇐ ПредыдущаяСтр 23 из 23
Механизм большинства одностадийных химических взаимодействий, а также отдельных стадий многостадийных процессов, включает формирование т.н. активированного комплекса (а.к.) в качестве промежуточного продукта. Активированный (или переходный[45]) комплекс – это такая ассоциация взаимодействующих (в элементарном акте реакции) частиц, при формировании которой происходит ослабление старых химических связей и зарождение новых (еще относительно слабых). Например, в случае одностадийного трехмолекулярного процесса:
при столкновении двух частиц
в котором затем рвется связь Итак, для образования активированного комплекса частицы должны столкнуться при определенной ориентации относительно друг друга (в нашем примере молекулы NO ‑ атомами азота с двух сторон частицы Cl2). При этом, чтобы а.к. сформировался, сталкивающиеся молекулы должны обладать достаточно высокой энергией, т.е. соответствующей величине ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ Влияние Т на скорость процесса отражает формула Вант-Гоффа: где У правила Вант-Гоффа есть много ограничений. Более полно отражает зависимость константы скорости, а значит и скорости процесса, от температуры уравнение Аррениуса:
где k – константа скорости, А – параметр, учитывающий число удачных столкновений, e – основание натурального логарифма, ∆Еа – энергия активации, R - универсальная газовая постоянная, Т – температура.
КАТАЛИЗ Катализаторами называют вещества, которые,не расходуясь в ходе процесса, ускоряют его, ибо они направляют реакцию по другому пути с меньшими значениями
[2] Однако, есть сведения, что даже при об.у. не только бактерии, но и человек способен усваивать азот воздуха, если не хватает белка в пище, и т.о. N2 может поддерживать жизнь. Кроме того, под высоким давлением азот растворяется в липидах (жировых тканях) животных и человека, оказывая на них наркотическое действие. Так что N2 при определенных условиях биологически активен. [3] Благодаря способности NH3 присоединять протон возможна очистка воды от аммиака с помощью катионитовв Н-форме – это твердые нерастворимые в воде очень многоосновные кислоты. Ионы Н+ данных кислот образуют прочную связь с молекулами NH3, поэтому аммиак поглощается из воды (при прохождении ее через слои гранул катионита). [4] N2O называют «веселящим газом», т.к. он оказывает на организм наркотическое действие (правда, слабое), и еще в 1844 года использовался в медицине для обезболивания при операциях. [5] Почва считается кислой, если концентрация ионов водорода в ее природном растворе в 300 раз выше, чем в чистой воде. [6] В природе встречаются, хотя и редко, также самородки металлического алюминия. [7] Самый большой искусственный сапфир, полученный в 2008 году, имеет длину 80 см. [8] Очень красивой разновидностью соединений алюминия и кремния является лазурит – минерал интенсивно синего цвета (Al2SiO4(SO4,Cl,S)1-2). Крупные его образцы – драгоценные камни (ванна Екатерины II была сделана из лазурита, что удивляло и восхищало иностранцев). А из его крошки готовят ультрамарин (краска художников эпохи Возрождения). К драгоценным камням относится и сине-зеленая бирюза – водный фосфат алюминия и меди CuO.3A2O3.2P2O5.9H2O. (В результате обезвоживания бирюза старится, поэтому для сохранения ее покрывают животным жиром.) [9] Это используют в металлургии (в т.н. «алюмотермии») для получения Cr, Mn, V и др. [10] «Коррозия» в переводе с латинского означает «разъедание». [11] Содержание углерода в антраците 96%, в буром угле – 72%, а в сухой древесине – 50%. [12] К кварцам относится и горный хрусталь – размер некоторых его природных кристаллов достигает 2 м. [13] Из сиенита сложены знаменитые «Красноярские Столбы». [14]На практике часто используют концентрационную константу равновесия, т.е. выраженную через С (в относительных единицах), поэтому обозначают [15] Мы не рассматриваем сверхвысокие давления, которые влияют на активности веществ даже когда они находятся в конденсированном состоянии. [16] Это уравнение является для микромира тем же, что и закон Ньютона для макротел. [17] Металлический блеск объясняется делокализацией электронов в М, в результате чего они практически не пропускают свет через себя (в отличие, например, от алмаза или стекла), а отражают его. Причем чем менее рассеивается отраженный свет, тем более блестит металл. [18] Отметим, что для элементов указанной диагонали номер группы совпадает с номером периода. [19] Соль названа в честь врача и химика Глаубера, который жил в 17 веке и впервые получил многие вещества, в том числе и эту соль, а также установил ее послабляющее действие. [20] И другие виды энергии в конечном итоге переходят в тепловую. [21] Быть функцией пути процесса – это значит зависеть от этого пути, т.е. от того, каким образом изменяются параметры системы (T, p, V и x) при осуществлении процесса. [22] Буква r – начальная в англ. слове «reaction», что значит «реакция». [23] В химии часто используется единица давления – атмосфера, и стандартное условие по давлению – это р=1 атм. (или 760 мм ртутного столба). [24] Буква f – начальная в англ. слове «formation», что значит «образование». [25] От греческого «эн» – в и «тропе» – превращение. [26] Стандартные значения S рассчитаны для одного моля каждого соединения, находящегося в наиболее устойчивом его состоянии, при p=1 атм. и T=298К. [27] Иногда вместо активностей газообразных веществ берут парциальные давления (их стандартные значения равны 101325 Па или 1 атм. по каждому газу данной системы). [28] Если вещество имеет неопределенный состав, то его формулу записывают как формулы оксидов, соединенные точкой; хотя это не смесь оксидов, а их химическое соединение. В частности, SiO2. nH2O содержит химически связанную воду в виде полимерной кремниевой кислоты. [29] Выветривание, например, гранита, заключается в том, что входящие в него слюда и полевой шпат, являясь алюмосиликатами примерного состава K2O.Al2O3.6SiO2, реагируют с водой и углекислым газом воздуха, образуя растворимый K2CO3 и нерастворимые порошки песка SiO2 и глины Al2O3.2SiO2.H2O. Да еще остаются мелкие кристаллы кварца (SiO2), которые были включены в гранит. [30] Чем выше ионность ХС в веществе, тем больше величина эффективных зарядов на атомах а, значит, тем прочнее связи они образуют с молекулами воды. Следовательно, значительнее движущая сила процесса растворения и, как результат, выше растворимость. [31] Возгонка – это переход вещества при нагревании из твердого состояния сразу в газообразное, минуя жидкое. [32] Раствор HCl называют также соляной кислотой, т.к. раньше хлорид водорода получали, действуя на твердую соль (NaCl) концентрированной серной кислотой (при сильном нагревании). [33] Эти реакции используются в промышленности для синтеза хлоридов металлов. [34] Качественной называется реакция, которая позволяет устанавливать наличие того или иного вещества в данной системе по внешнему эффекту, наблюдаемому при проведении этой реакции. [35] Благодаря способности NH3 присоединять протон возможна очистка воды от аммиака с помощью катионитовв Н-форме – это твердые нерастворимые в воде очень многоосновные кислоты. Ионы Н+ данных кислот образуют прочную связь с молекулами NH3, поэтому аммиак поглощается из воды (при прохождении ее через слои гранул катионита). [36] N2O называют «веселящим газом», т.к. он оказывает на организм наркотическое действие (правда, слабое), и еще в 1844 года использовался в медицине для обезболивания при операциях. [37] Сжижение происходит, если энергия связимежду молекуламивыше, чем энергия их беспорядочного (теплового) движения. [38] Молекулы гелия одноатомны, имеют устойчивую конфигурацию 1s2 и меньший (чем у водорода) атомный радиус из-за большего заряда ядра. В результате чего ДВ между атомами Не слабее, чем между Н2, поэтому т. кип. гелия ниже ( – 269°С), хотя его молекулы тяжелее.
[39] Металлический блеск объясняется делокализацией электронов в М, в результате чего они практически не пропускают свет через себя (в отличие, например, от алмаза или стекла), а отражают его. Причем чем менее рассеивается отраженный свет, тем более блестит металл. [40] Отметим, что для элементов указанной диагонали номер группы совпадает с номером периода. [41] В случае многостадийного процесса имеется в виду лимитирующая его стадия. [42] А также в случае лимитирующей стадии многостадийных реакций. [43] Кинетическое уравнение можно записать через концентрации, но тогда оно не является строгим, т.к. не учитывает «постороннее» межчастичное взаимодействие. [44] Влияние природы реагентов - это значит, что для каждой реакции - свои значения [45] Время его существования – порядка 10-12 с.
Поиск по сайту: |
 ,
, и одной
и одной  получается а.к. следующего вида:
получается а.к. следующего вида: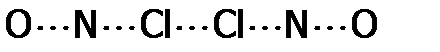 ,
, и упрочняются связи
и упрочняются связи  (пунктиром показаны ослабленные связи без уточнения их кратности). При осуществлении обратной реакции – наоборот, но а.к. тот же. Возможный механизм протекания одностадийного двухмолекулярного взаимодействия показан на рис. 1, линия (а).
(пунктиром показаны ослабленные связи без уточнения их кратности). При осуществлении обратной реакции – наоборот, но а.к. тот же. Возможный механизм протекания одностадийного двухмолекулярного взаимодействия показан на рис. 1, линия (а). (рис. 1). Часто из-за слишком большого значения
(рис. 1). Часто из-за слишком большого значения  (практически не достигаемого частицами в условиях опыта) не идет даже термодинамически разрешенный процесс.
(практически не достигаемого частицами в условиях опыта) не идет даже термодинамически разрешенный процесс. ,
, и
и  ‑ скорости взаимодействия при
‑ скорости взаимодействия при  и
и  соответственно, а
соответственно, а  ‑ температурный коэффициент, который для разных реакций принимает разные значения в интервале от 2 до 4. Из правила Вант-Гоффа следует, что при повышении Т на каждые 100 скорость увеличивается в 2 – 4 раза.
‑ температурный коэффициент, который для разных реакций принимает разные значения в интервале от 2 до 4. Из правила Вант-Гоффа следует, что при повышении Т на каждые 100 скорость увеличивается в 2 – 4 раза. ,
, , хотя и с бóльшим числом стадий (рис. 1, линия (б)).
, хотя и с бóльшим числом стадий (рис. 1, линия (б)). . Величина
. Величина  ), но и (в небольшой степени) от других параметров системы, в частности, от концентрации.
), но и (в небольшой степени) от других параметров системы, в частности, от концентрации. и
и  .
.