 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ФОРМУЛА ГИББСА. РАЗРЕШЕННОСТЬ ПРОЦЕССОВ С ПОЗИЦИИ ТЕРМОДИНАМИКИ
Из графика (в виде соотнесенных отрезков), приведенного выше, видно, что
Причем, если изменение G положительно ( Рассмотрим взаимодействия в системах, в которых начальные условия стандартные: Т=298К, р=1атм. и, кроме того, т.н. эффективные концентрации каждой из реагирующих частиц равны по 1моль/л. (Имеются в виду частицы (молекулы, ионы и т.п.) не только исходных веществ, но и продуктов взаимодействия.) Эффективная концентрация иначе называется активностью [27] (обозначается буквой а). Она равна произведению коэффициента активности (f) на истинную концентрацию частиц данного сорта (C): a=f∙C. Коэффициентактивности показывает долю сравнительно свободных (активных) частиц, не участвующих в «постороннем» межчастичном взаимодействии (ибо оно не приводит к осуществлению данной реакции, поэтому «отвлекает» от нее.) Так, для процесса: А + В = С, «посторонней» является ассоциация частиц А и B не между собой, а с C или со стенками сосуда и т.п. Подчеркнем, что стандартные значения активностей частиц (ai=1 моль/л) могут соблюдаться лишь в первый момент реакции. А далее, если процесс идет, например, вправо, активности частиц реагентов снижаются, а продуктов – растут. Для стандартных условий формула Гиббса запишется следующим образом:
Причем аналогично рассмотренному выше, при ст.у. тоже, если Формула (3а) позволяет оценить термодинамическую разрешенность процесса при любой (не только стандартной) температуре, используя
(Подчеркнем, что в соответствии с формулой (3б) величина Используя формулу (3б), проведем оценку знака Случай 1. Если Случай 2. Если Случай 3. Если а) б) Температуру смены знака Случай 4. Если Изменение
Метан Метан СН4 (бесцветный газ) можно синтезировать по реакции, используя кроме нагрева еще и катализатор (Ni):
Однако на практике метан выделяют из природных газов (содержащих 60-90% СН4), что гораздо дешевле. Природные газы – это, например, рудничные, а также болотные. (Они получаются при разложении останков растений и животных в отсутствии кислорода.) Входит СН4 и в состав коксового газа (образующегося при нагревании угля без доступа воздуха). Во многих странах действуют установки получения метана анаэробной тепловой (40-60°С) переработкой отходов животноводства. При этом одновременно гибнут болезнетворные микробы и исчезает неприятный запах навоза; таким образом, он превращается в безвредное и очень ценное удобрение для полей. Молекула СН4 является тетраэдром (sp3-гибридизация орбиталей углерода), т.е. симметричной частицей, поэтому (несмотря на полярность связей) неполярной. Как следствие, метан имеет низкую температуру сжижения (–162°С), практически не растворяется в воде и при об.у. химически достаточно инертен – не взаимодействует с растворами кислот и щелочей. Однако его смеси с воздухом взрывоопасны, что часто бывает причиной несчастных случаев на угольных шахтах. Используется метан, в основном, как топливо, а также для получения водорода реакцией с парами воды (второй продукт – СО).
Поиск по сайту: |
 , следовательно, G – тоже функция состояния (при
, следовательно, G – тоже функция состояния (при  ), поэтому изменение свободной энергии в ходе реакции можно рассчитать по формуле (она называется формулой Гиббса):
), поэтому изменение свободной энергии в ходе реакции можно рассчитать по формуле (она называется формулой Гиббса): . (3)
. (3) ), то это означает, что свободная энергия системы при взаимодействии веществ должна самопроизвольно возрастать, что невозможно, поэтому такой процесс запрещен. Если же изменение G отрицательно (
), то это означает, что свободная энергия системы при взаимодействии веществ должна самопроизвольно возрастать, что невозможно, поэтому такой процесс запрещен. Если же изменение G отрицательно (  ) т.е. энергия Гиббса в ходе реакции уменьшается, то процесс должен идти самопроизвольно.
) т.е. энергия Гиббса в ходе реакции уменьшается, то процесс должен идти самопроизвольно. . (3а)
. (3а) , то процесс должен идти самопроизвольно, а при
, то процесс должен идти самопроизвольно, а при  реакция запрещена.
реакция запрещена. и
и  (см. разделы 2.1.1 и 2.1.2), поскольку значения
(см. разделы 2.1.1 и 2.1.2), поскольку значения  и
и  мало зависят от T. Для простоты будем записывать их, соответственно, как
мало зависят от T. Для простоты будем записывать их, соответственно, как  и
и  , а изменение G при взаимодействии в ст.у. (кроме значения T, т.е. при любой заданной температуре) обозначим, как
, а изменение G при взаимодействии в ст.у. (кроме значения T, т.е. при любой заданной температуре) обозначим, как  и получим:
и получим: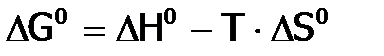 . (3б)
. (3б) постоянна при каждой данной Т для данной реакции.)
постоянна при каждой данной Т для данной реакции.) , а значит, термодинамическую разрешенность химического взаимодействия в зависимости от температуры для четырех возможных случаев.
, а значит, термодинамическую разрешенность химического взаимодействия в зависимости от температуры для четырех возможных случаев. (экзопроцесс), а
(экзопроцесс), а  (рост энтропии в ходе реакции), то при любой Т имеем
(рост энтропии в ходе реакции), то при любой Т имеем  . И, следовательно, взаимодействие должно идти самопроизвольно, как, например, реакция:
. И, следовательно, взаимодействие должно идти самопроизвольно, как, например, реакция:  .
.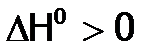 , а
, а  , то при любой температуре
, то при любой температуре  . А значит, процесс термодинамически запрещен (это реакция, обратная предыдущей).
. А значит, процесс термодинамически запрещен (это реакция, обратная предыдущей). и
и  (что соответствует, в частности, взаимодействию:
(что соответствует, в частности, взаимодействию:  ), то возможны два варианта:
), то возможны два варианта: (это более вероятно при низкой Т), следовательно,
(это более вероятно при низкой Т), следовательно,  , и значит, реакция разрешена;
, и значит, реакция разрешена;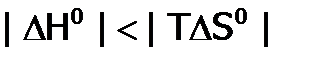 (что более вероятно при высокой Т), как результат,
(что более вероятно при высокой Т), как результат,  , т.е. процесс запрещен.
, т.е. процесс запрещен. можно рассчитать, приравняв
можно рассчитать, приравняв  равным нулю, тогда из формулы (3б) получим:
равным нулю, тогда из формулы (3б) получим:  .
.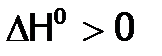 и
и  (реакция, обратная предыдущей), то возможны те же два варианта (рассмотрите их сами), но выводы обратные.
(реакция, обратная предыдущей), то возможны те же два варианта (рассмотрите их сами), но выводы обратные. в процессе можно посчитать по формулам, аналогичным формулам изменения энтальпии и энтропии, используя табличные значения
в процессе можно посчитать по формулам, аналогичным формулам изменения энтальпии и энтропии, используя табличные значения  :
:
 .
.