 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Распространенность водорода
Водород (Н) – первый элемент Периодической таблицы, т.е. электронная конфигурация Н – 1s1, а его ядро – это лишь один протон. Вследствие своей простоты водород является самым распространенным элементом Космоса (составляет 90% вещества Вселенной). Это и звезды, и межзвездная среда, и газовые туманности. Большинство звезд начинает свой жизненный путь в виде газового водородного шара. Проходят миллионы лет, и Н внутри звезды «выгорает», переходя в другие более сложные элементы. За счет этого светит и Солнце, 70% массы которого составляет водород. (Солнцу светить, по расчетам ученых, еще 30 млрд. лет.) На Земле водород по распространенности занимает четвертое место. Его кларк (т.е. молярная доля среди других элементов в природе) равен 3%. Причем формы нахождения Н на Земле – это, в основном, вода и органические соединения. Сходство водорода с другими элементами Вследствие того, что водород имеет один валентный электрон, его можно отнести к IА подгруппе Периодической таблицы, т.е. к щелочным металлам (ЩМ). С другой стороны, поскольку на первом уровне атома может находиться два е, то частице Н до завершения уровня не хватает одного электрона, что делает водород похожим на галогены (Г), относящиеся к VIIА подгруппе. Кроме того, Н обнаруживает сходство с углеродом (из IVА подгруппы), в частности, близки значения их электроотрицательностей: 2,1 у Н и 2,5 у C (по шкале Поллинга). Причем эти ЭО имеют среднюю величину. Как следствие, водород и углерод одинаково склонны к образованию ковалентных связей. (Именно поэтому они вместе дают многочисленные органические соединения.) Таким образом, видимо, имеет смысл поместить Н в одну длинную клетку, расположенную надвсеми подгруппамис IА по VIIА. Рассмотрим подробнее, в чем проявляется сходство водорода с Г и ЩМ. Сходство с галогенами (1)Роднит водород с Г (и одновременно резко отличает его от ЩМ) сравнительно высокая электроотрицательность Н. (Сравним, у лития ЭО равна 1, в то время как у водорода – 2,1, а у иода – 2,5.) В результате чего атомы Н друг с другом образуют не металлическую связь, как ЩМ, а ковалентную. А т.к. она направленаинасыщаема, то при одном неспаренном электроне могут сформироваться лишь двухатомные молекулы (2) И водород, и галогены, стремясь завершить валентные уровни своих атомов, проявляют окислительные свойства. Однако Н из-за малого Z ядра имеет меньшее сродство к электрону, чем даже иод. Поэтому
(3) Продукты данных реакций (они называются гидридами) – твердые вещества, имеющие ионную решетку, как и галиды (в частности, хлориды NaCl или
Эту реакцию используют для получения
Поиск по сайту: |
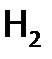 , как и в случае галогенов (
, как и в случае галогенов (  ).
). . (Сравним:
. (Сравним:  , а даже у иода
, а даже у иода  .) Как следствие, водород реагирует лишь с достаточно сильными восстановителями; такими, как, например, ЩМ и щелочно-земельные металлы (ЩЗМ):
.) Как следствие, водород реагирует лишь с достаточно сильными восстановителями; такими, как, например, ЩМ и щелочно-земельные металлы (ЩЗМ): ,
, .
. ). Но гидриды (в отличие от галидов) очень сильные восстановители. Поскольку Н– слишком слабо удерживает электрон (из-за сравнительно малого сродства к нему атома водорода). Вследствие этого гидриды (но не галиды) при обычных условиях окисляются даже водородом воды:
). Но гидриды (в отличие от галидов) очень сильные восстановители. Поскольку Н– слишком слабо удерживает электрон (из-за сравнительно малого сродства к нему атома водорода). Вследствие этого гидриды (но не галиды) при обычных условиях окисляются даже водородом воды: .
.