 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Кислородосодержащие соединения хлора
Термодинамическую окислительную (или восстановительную) активность соединений в водной среде характеризует потенциал Е0 Его величина опосредованно учитывает тепловые эффекты ( Тепловые эффекты перехода Г2 в гидратированный галид-ион Таблица 3
Подчеркнем, что вещество является тем более сильным окислителем (а значит,величина Е0 тем положительнее), чем слабее химические связи в исходных веществах (в частности, в молекуле Г2), чем больше сродство к электрону элемента, принимающего е и чем прочнее ХС в продуктах ( в нашем случае – чем выше теплота гидратации аниона Г–). Несмотря на то, что фтор имеет меньшее сродство к электрону, чем хлор ( табл.3), F2 как окислитель термодинамически значительно сильнее по сравнению с Cl2. Это объясняется меньшей энергией атомизации F2, чем Cl2 и значительно большей (по сравнению с Cl–) теплотой гидратации анионов F– (из-за меньшего их радиуса ). Максимальная (среди Г2) кинетическая активность фтора проявляется также и в водной среде. Например, если F2 сгорает в воде (фиолетовым пламенем):
а значит, реакция идет крайне быстро, то Cl2 (и тем более Br2 и I2) при об.у. реагирует с Н2О спокойно. А поскольку Cl2 (и его аналоги) имеют способность не только окислять, но и (в отличие от фтора) окисляться, то реагируют с водой по типу самоокисления-самовосстановления (дисмутации). При этом один атом, например, хлора отдает электрон, переходя в
С точки зрения термодинамики данная реакция не очень обусловлена, ибо для нее К=4,2 10–4, а значит, равновесие процесса сдвинуто влево. Следовательно, основная часть хлора присутствует в его водном растворе (в т.н. хлорной воде) в виде молекул В то же время реакция фтора с водой идет необратимо, т.е. ее равновесие полностью сдвинуто вправо. Подчеркнем, что хлорная вода является сильным окислителем, т.к. присутствующая в ней хлорноватистая кислота На практике для этих целей обычно используют соли хлорноватистой кислоты, поскольку они устойчивее, чем сама кислота и, значит, более удобны в обращении. В частности, применяют соль кальция, которую синтезируют по реакции:
Продукт (смесь образующихся солей) называется хлорной известью (т.к. получается из извести) или белильной, за то, что отбеливает ткани.. Отбеливание происходит из-за окисления хлорноватистой кислотой, которая, являясь слабымэлектролитом, образуется при гидролизе Сa(ClO)2. Отметим, что если Cl2 пропускать через горячую щелочь, то окисление хлора при дисмутации идет до ст.ок. +5, т.е. получаем хлорат калия, т.н. бертоллетову соль (KClO3):
Хлорат калия (в отличие от HClO3) устойчив в свободном состоянии (т.е. в виде твердой соли). Однако при нагревании эта соль легко отщепляет атомарный кислород (переходя в KCl). Поэтому Например, при взрыве пороха, содержащего серу, уголь и бертоллетову соль, идут процессы, которые суммарно отражаются уравнением:
Кроме приведенных выше кислородосодержащих веществ хлора (в ст.ок. +1 и +5) можно получить также соединения Cl(III) и Cl(VII).
Взаимодействие Г2 с водородом. Получение HCl и ее свойства. Галогеноводородные кислоты Водород и термодинамически, и кинетически достаточно пассивное вещество, поэтому в реакциях с ним особенно явно видно различие в химическом поведении соединений, в частности, галогенов. Так, иод (с позиции термодинамики наиболее слабый окислитель среди Рассмотрим подробнее реакцию водорода с хлором, имеющую промышленное значение. При обычных условиях в смеси Кипит он при – 850С, т.е. (несмотря на бóльшую молекулярную массу) ниже, чем HF (+190С). Причина – менее сильные связи между молекулами Хлорид водорода (как и другие HГ), благодаря полярности молекул, хорошо растворим в воде: 507 л в 1 л воды (при 00С), что соответствует массовой доле 45%. Растворы НГ в воде называются галогеноводородными[32] кислотами. Сила кислот от HF к HI увеличивается, вследствие роста радиуса галогена. Так, Хлороводородная кислота является сильной (
А также с солями, если при этом образуется слабая кислота или осадок хлорида М:
Подчеркнем, что с помощью AgNO3 можно проводить качественные реакции[34] на галид-ионы, с целью различить их между собой. А именно: AgF хорошо растворим, Отметим, что хлороводородная кислота входит в состав желудочного сока, т.е. участвует в переваривании пищи, поэтому ее используют в медицине (принимают при пониженной кислотности желудка), а также в пищевой промышленности. 30
идет с выделением тепла (46,2 кДж/моль). Следовательно, как и при окислении SO2 до SO3, увеличение температуры должно снижать выход продукта, но в промышленности вынуждены повышать Т до 4000C (несмотря на присутствие катализатора), чтобы скорость процесса была достаточно высокой. Кроме того, для большего выхода NH3 увеличивают давление до 200-1000 атмосфер, поскольку реакция идет с уменьшением объема. Но даже в этих жестких условиях выход аммиака не более 30%. Правда, его легко отделить от непрореагировавших исходных веществ (азота и водорода), т.к. NH3 имеет сравнительно высокую т.кип. (–33,4°С) благодаря действию между его молекулами Н-связей. А под большим давлением, которое создается в системе при синтезе аммиака, он сжижается даже при комнатной температуре. (Остающиеся при этом газы N2 и H2 возвращаются обратно в колонну синтеза NH3.) До сих пор ведутся работы по улучшению катализатора (например, добавлением к нему т.н. активаторов), чтобы снизить температуру процесса и т.о. повысить выход аммиака. Его мировое производство составляет несколько десятков миллионов тонн в год. Поэтому даже небольшое увеличение выхода NH3 оборачивается большим сокращением затрат на его получение. Испытаны уже тысячи веществ, но пока катализаторы, созданные человеком, далеки по эффективности от биологического, который работает в азобактериях и связывает азот воздуха при обычных условиях. Аммиак представляет собой бесцветный газ и со столь резким запахом, что вдыхание его приводит людей, потерявших сознание, в чувство. Растворимость аммиака в воде максимальна среди известных газов (в 1л – 700 л при 20°С). Это объясняется полярностью частиц NH3 (рисунок 4) и их способностью к образованию Н-связей с молекулами растворителя. Кроме того, имеющаяся у атома азота НЭП (на рисунке 4 она изображена жирными точками) слабее удерживается ядром N, чем НЭП ядром О в молекуле воды (из-за большего r азота и меньшего заряда его ядра). Как следствие, эта электронная пара легче предоставляется на донорно-акцепторную связь с протоном[35] воды. В результате чего образуются устойчивые гидраты аммиака, например, NH3 . H2O (точнее: Н3N . HOН), что значительно повышает растворимость NH3. К тому же, часть молекул гидрата аммиака (примерно 4 из 1000) в водном растворе NH3 находится в диссоциированном состоянии:
При диссоциации протон Н2О передается молекуле NH3 полностью, а оставшийся от воды ОН–-ион создает щелочную среду. Но поскольку гидрат аммиака является слабым электролитом, то создает не сильно щелочную среду: рН около 11. (А раствор гидроксида натрия может иметь pH>14.) Из-за стремления N в наиболее устойчивую нулевую ст.ок. аммиак проявляет себя как восстановитель. Например, по отношению к оксидам металлов:
Еще легче аммиак (тоже переходя в N2) восстанавливает Г2 (до Г–) и Н2О2 (до Н2О). Соли аммония При добавлении кислоты равновесие смещается вправо как результат связывания ОН–-ионов в Н2О, т.е. идет обычная реакция нейтрализации:
При этом образуется соль NH4Cl, которая называется нашатырем или хлоридом аммония. Все соли, содержащие катионы Подчеркнем, что донорные свойства аммиака из-за наличия НЭП столь сильны, а следовательно, ХС азота с 4-м Н+ столь прочна, что
То есть в этих реакциях
Образующийся при этом гидрат аммиака легко отщепляетNH3. (Поэтому им пахнут все соли аммония.) Гидролиз резко усиливается при добавлении щелочи, т.к. ионы ОН–, связывая протоны в молекулы очень слабого электролита Н2О, переводят
(Данная реакция является качественной на ионы аммония – их присутствие легко устанавливается по запаху, характерному для аммиака). Разрушается
При этом разрываются химические связи (между NH3 и H+), поэтому процесс называется химической возгонкой (в отличие от физическойвозгонки, например, I2, идущей без разрушенияХС). Если получающиеся газы (NH3 и HCl) по газоотводной трубке направить в другой (не нагреваемый) сосуд, то, охлаждаясь в нем, они снова образуют соль NH4Cl. Возгонка солей аммония используется для отделения их от нелетучих веществ (в частности, NaCl). Кроме того, способность нашатыря разлагаться помогает, например, очищать поверхность медного паяльника от оксида меди. А именно: хлороводород (он образуется из хлорида аммония на горячем паяльнике) реагирует с оксидом меди:
а NH3 восстанавливает медь в CuCl2 до Cu0 (другие продукты: N2 и HCl).
Поиск по сайту: |
 ) всех отдельных стадий процесса. В таблице 3 приведены стадии (и их значения
) всех отдельных стадий процесса. В таблице 3 приведены стадии (и их значения 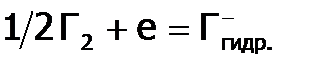 (здесь
(здесь 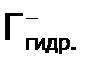 – гидратированный галид-ион).
– гидратированный галид-ион).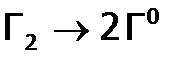


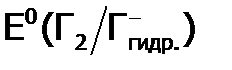 , В
, В
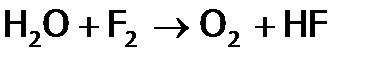 ,
,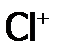 (в составе HClO), а другой – забирает е, образуя
(в составе HClO), а другой – забирает е, образуя 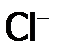 :
: .
.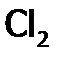 ; и лишь немногие из них (примерно 1 из 14) настолько поляризуются водой, что происходит их дисмутация.
; и лишь немногие из них (примерно 1 из 14) настолько поляризуются водой, что происходит их дисмутация. неустойчива, и легко разлагается. При этом образуется HCl и атомарный кислород– очень активный реагент, который (окисляя) может и дезинфицировать, и отбеливать.
неустойчива, и легко разлагается. При этом образуется HCl и атомарный кислород– очень активный реагент, который (окисляя) может и дезинфицировать, и отбеливать. .
.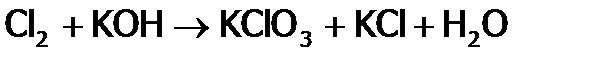 .
. в сухом виде применяют для очень быстрого (взрывного) окисления восстановителей. С этой целью его вводят в состав спичек, пороха, зажигательных смесей (которые используются для фейерверков) и др.
в сухом виде применяют для очень быстрого (взрывного) окисления восстановителей. С этой целью его вводят в состав спичек, пороха, зажигательных смесей (которые используются для фейерверков) и др. .
. ) реагирует с водородом обратимо (К=54,4 при 4250С), в то время как другие галогены – практически необратимо. Снизу вверх в подгруппе растет и кинетическая активность
) реагирует с водородом обратимо (К=54,4 при 4250С), в то время как другие галогены – практически необратимо. Снизу вверх в подгруппе растет и кинетическая активность  выше 3000С, хлор – на свету при об.у., а фтор – со взрывом даже в темноте. (Продукт HF часто записывают формулой
выше 3000С, хлор – на свету при об.у., а фтор – со взрывом даже в темноте. (Продукт HF часто записывают формулой 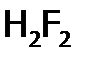 .)
.) направить в атмосферу CI2 и сразу же поджечь, то идет спокойное горение (зеленым пламенем). Так получают хлорид водорода в промышленности.
направить в атмосферу CI2 и сразу же поджечь, то идет спокойное горение (зеленым пламенем). Так получают хлорид водорода в промышленности. . А далее в подгруппе от HCl к НI значения т.кип. растут.
. А далее в подгруппе от HCl к НI значения т.кип. растут.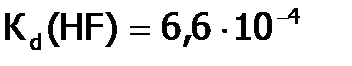 , а
, а 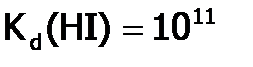 .
.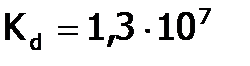 ). Она вступает во все реакции, характерные для данного класса веществ. А именно: HCl взаимодействует с М[33] , стоящими в ряду напряжений левее, с оксидами металлов, со щелочами и малорастворимыми гидроксидами:
). Она вступает во все реакции, характерные для данного класса веществ. А именно: HCl взаимодействует с М[33] , стоящими в ряду напряжений левее, с оксидами металлов, со щелочами и малорастворимыми гидроксидами: ,
, ,
,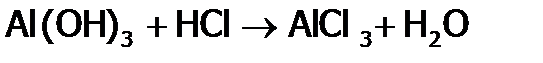 .
.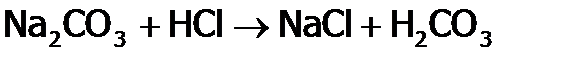 ,
,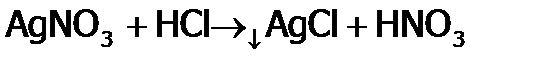 .
. белый осадок,
белый осадок, 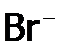 – желтоватый, a
– желтоватый, a  – желтый. С другой стороны, ионы
– желтый. С другой стороны, ионы 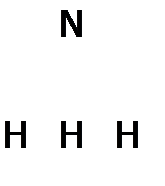
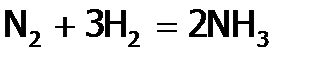
 , Кd=1,8 10-5.
, Кd=1,8 10-5. .
. .
. , стали называть солями аммония.
, стали называть солями аммония. сохраняет свою целостность при реакциях обмена солей аммония с другими солями или с кислотами:
сохраняет свою целостность при реакциях обмена солей аммония с другими солями или с кислотами: ,
, .
. .
.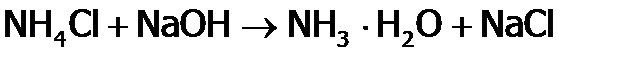 .
. .
. ,
,