 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Оксиды и гидроксиды азота. Соли
Получение оксидов и кислот При нагревании аммиак горит в кислороде (зеленым пламенем) с образованием N2 и воды. По этой реакции при формировании земной атмосферы весь NH3, который был когда-то ее основным компонентом, окислился до азота (кислородом, выделявшимся из раскаленных недр Земли). Однако если процесс проводить в присутствии катализатора (Pt), то окисление аммиака идет до NO. Это используется в производстве азотной кислоты. Образующийся оксид NO (бесцветный газ) затем легко (при об.у.) окисляется кислородом воздуха до NO2 (бурый газ). А диоксид азота реагирует с водой, насыщенной кислородом под давлением 5 МПа, давая 65%-ый раствор HNO3. (Примерно 1/3 промышленного аммиака идет на производство азотной кислоты, ее солей и др.) Отметим, что прямое окисление N2 кислородом до NO требует или сильного нагрева или применения электрической дуги, что тоже очень дорого. В атмосфере данная реакция осуществляется под действием разрядов (их на Земле ежесекундно происходит около 100). Эти разряды наряду с азобактериями обеспечивают круговорот N в природе (рисунок 5).
36. Чистую азотную кислоту можно синтезировать гидратацией N2O5 (твердого вещества), поскольку в нем ст.ок. N та же, что и в азотной кислоте. Но это дорогой способ, т.к. сам оксид азота (V) получают, действуя на NO2 очень сильным, а значит, недешевым окислителем (например, озоном). К тому же, N2O5 легко при об.у. отщепляет кислород, переходя снова в устойчивый диоксид. Характеристики 3-х наиболее стабильных оксидов азота даны в таблице 4. Характеристики наиболее устойчивых оксидов азота Таблица 4
Раньше HNO3 получали в промышленности, действуя концентрированной серной кислотой на природную селитру (воздушно-сухую):
Однако синтез азотной кислоты из аммиака настолько ее удешевил, что, напротив, стали применять HNO3 в производстве ее солей. В лаборатории используют готовую (товарную) азотную кислоту или получают реакцией серной кислоты с нитратом бария. Свойства и применение Азотная кислота по сравнению с азотистой, во-первых, сильнее, а во-вторых, более устойчива – даже выделена в свободном состоянии (это бесцветная жидкость с т. кип. 86°С). Однако она (и в виде водного раствора) разлагается при об.у. (хотя и медленно) на NO2, О2 и H2O. Продукты взаимодействия HNO3 с металлами зависят как от концентрации кислоты, так и от активности М. Например, цинк восстанавливает разбавленную азотную кислоту до ионов аммония, концентрированную – до оксида азота (I), в то время как медь – лишь до оксида азота (II) и оксида азота (IV) соответственно. Концентрированная азотная кислота, благодаря образованию при ее разложении атомарного кислорода, растворяет даже серебро (но не Au, Pt и т.п.), хотя пассивирует железо, алюминий и хром. Кроме того, конц. HNO3 легко окисляет простые вещества многих неметаллов: графит до Очень концентрированная азотная кислота легко воспламеняет опилки и другие горючие материалы, поэтому используется как окислитель ракетного топлива. Кроме того, азотная кислота применяется для приготовления лекарств, пластмасс, красителей, искусственных волокон и т.п., а также взрывчатых веществ (например, нитроглицерина, который является основой динамита). Представляет собой жидкость жёлтого цвета, пахнущую хлором и оксидами азота. Сильнейший окислитель, благодаря хлористому нитрозилу (), распадающемуся с выделением хлора:
За счёт выделения атомарного хлора растворяет большинство металлов, в том числе золото, поэтому и названа алхимиками царской водкой, так как золото считалось «царём металлов». Не растворяет тантал (Ta), титан (Ti). Рутений (Ru) растворяется в царской водке только в присутствии кислорода воздуха, образуя комплексное соединение — гексахлоро-рутениевую кислоту[1]. Родий (Rh) и иридий (Ir) в компактном состоянии не реагируют с кислотами, в том числе и с царской водкой. В виде тонких порошков (чернь) эти металлы реагируют с царской водкой. 38. Водород
Поиск по сайту: |


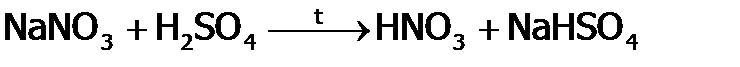 .
.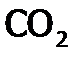 , фосфор до
, фосфор до  , серу до
, серу до 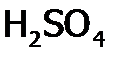 , иод до
, иод до  и др., восстанавливаясь при этом, как правило, до оксида азота (II). Реагирует она и с органическими веществами – основные продукты их полного окисления: СО2 и Н2О.
и др., восстанавливаясь при этом, как правило, до оксида азота (II). Реагирует она и с органическими веществами – основные продукты их полного окисления: СО2 и Н2О.
