|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Методы выращивания культуры каллусных тканей
Поверхностное культивирование Культура каллусных тканей выращивается поверхностным способом на полужидкой агаризованной среде (концентрация агара – 0,6-1%), среде с применением других желирующих полимеров либо на мостиках из фильтровальной бумаги или дисках из пенополиуретана, погруженных в жидкую питательную среду. Каллусная ткань, выращиваемая поверхностным способом, представляет собой аморфную массу тонкостенных паренхимных клеток, не имеющую строго определенной анатомической структуры. Цвет массы может быть белым, желтоватым, зеленым, красным - пигментированным полностью или зонально. В зависимости от происхождения и условий выращивания каллусные ткани бывают: 1) рыхлыми, сильно обводненными, легко распадающимися на отдельные клетки, 2) средней плотности, с хорошо выраженными меристематическими очагами, 3) плотными с зонами редуцированного камбия и сосудов. Как правило, в длительной пересадочной культуре, на средах, включающих ауксины, особенно синтетический аналог ауксина 2,4-дихлорфеноксиуксусную кислоту (2,4-Д), каллусные ткани теряют пигментацию и становятся более рыхлыми. В цикле выращивания каллусные клетки после ряда делений проходят обычный для клетки растений онтогенез: они приступают к росту растяжением, затем дифференцируются как зрелые каллусные клетки и наконец деградируют. Каллусные клетки, выращиваемые поверхностным способом, часто применяют для сохранения в растущем состоянии коллекций разных штаммов, линий, мутантов, для регенерации растений, из них также получают суспензии клеток, культивируемых в жидкой питательной среде.
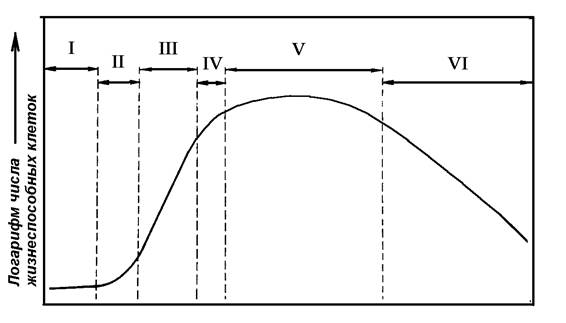
Суспензионное культивирование Культуры клеток растений, выращиваемые в жидкой питательной среде, обычно называют суспензионными культурами. Термин этот не является строго научным и очень точным, так как не объясняет основной особенности поведения клеток при таком выращивании. Получено еще сравнительно мало культур клеток высших растений, по своим параметрам полностью удовлетворяющих требованиям суспензионного (глубинного) культивирования. В значительной мере это объясняется трудностями получения культуры клеток, состоящей преимущественно из отдельных клеток или небольших их агрегатов. Представляется целесообразным поэтому сначала рассмотреть методы получения клеточной суспензии, а также обсудить само понятие суспензионной (глубинной) культуры применительно к растительным клеткам. Безусловно, выращивание клеточных суспензий в жидкой питательной среде имеет ряд преимуществ перед выращиванием каллусных клеток поверхностным способом. Здесь легче и более воспроизводимо влиять на метаболизм и рост клеточных популяций экзогенными факторами. Суспензионные культуры удобнее для проведения биохимических и молекулярно-биологических экспериментов – изучения индукции ферментов и связи их с событиями клеточного цикла, экспрессии и репрессии определенных генов, изолирования и характеристик мутантов. Суспензионную культуру можно получить из фрагментов органа растения (диски запасающей паренхимы мясистых корней моркови, петрушки, клубней картофеля и др.), однако этот путь более трудоемкий и требует большего времени. Клетки экспланта должны при этом образовывать первичный каллус, и только после этого поверхностные каллусные клетки, попавшие в жидкую среду и размножившиеся в ней, дадут начало линии, способной расти в суспензии. Обычно для получения культуры клеток используется культура каллусной ткани. Рыхлые обводненные культуры каллусных тканей более пригодны для перевода в суспензию, чем структурированные плотные каллусы. Оптимальными подходами для получения суспензии являются выращивание каллусов на среде с 2,4-Д, исключение из среды ионов кальция, обработка пектиназой транспланта, предназначенного для выращивания в суспензионной культуре. Для получения культуры клеток берется наиболее жизнеспособная (пролифелирующая) часть каллусной ткани, а ее количество должно быть в 15-20 раз больше в расчете на объем питательной среды, чем при серийном культивировании на агаре. При этом может использоваться питательная среда того же состава, что и для поверхностного культивирования, но в некоторых случаях увеличивают количество ауксинов и (или) уменьшают количество цитокининов. Режим перемешивания и аэрации при инициации культуры клеток обычно такой же, как и при дальнейших серийных субкультивированиях культур клеток на роллерах и качалках (круговая качалка – 10-12 оборотов/минуту). Образование первичной суспензии растительных клеток можно считать результатом трех процессов: 1) распадение каллусной ткани на клетки и небольшие клеточные агрегаты в момент внесения в жидкую питательную среду; 2) отделение клеток и клеточных агрегатов с поверхности кусочков ткани в течение первых субкультивирований; 3) деления и роста клеток, образовавшихся по первым двум способам, и распадения разрастающихся клеточных агрегатов на более мелкие агрегаты и клетки. Последний процесс является типичным для роста стабилизировавшейся перевиваемой культуры клеток высших растений. Первичную суспензию перед субкультивированием либо в специальном цилиндре разделяют на фракции по скорости седиментации (используют вехнюю фракцию) либо фильтруют через 1-2 слоя марли, нейлоновые или металлические сита, чтобы избавиться от крупных плотных кусков каллусной ткани, остатков экспланта и очень крупных агрегатов. Фильтрование рекомендуется и в нескольких последующих субкультивированиях до приобретения клеточной суспензией желательных характеристик. Однако агрегированность суспензии зависит не только от характеристик начальной линии, но и от условий культивирования. Для глубинного культивирования растительных клеток применяются способы, разработанные для микробиологических целей. Используются закрытые или открытые системы в периодическом или проточном режимах. Хотя, при глубинном выращивании растительных клеток принцип турбидостата практически не применяется. Одной из причин этого является разрушения части клеток при отводе их к оптическому прибору. Выращивание суспензии клеток растений в установках непрерывного культивирования по принципу хемостата применяется как для изучения метаболизма клеток, стабильно поддерживающихся в разных фазах клеточного цикла, так и при промышленном выращивании клеточной биомассы с целью получения экономически важных продуктов. Однако до настоящего времени наиболее изученным и распространенным режимом глубинного культивирования клеточных суспензий является закрытая периодическая система. В этом случае для аэрации и перемешивания суспензии используют роллеры, качалки (обычно круговые), ферментеры с механическими и магнитными мешалками или ферментеры барботажного типа, где аэрация и перемешивание осуществляется воздушным потоком. Критериями роста в цикле выращивания служит увеличение числа клеток, их сырой и сухой массы. Модельная ростовая кривая имеет типичную S-образную форму (рисунок 6).На ней различают:
Рис. 6. Фазы кривой роста популяции растительных клеток: I – лаг-фаза, II – экспоненциальная фаза, III – фаза линейного роста, IV – фаза замедленного роста, V – стационарная фаза, VI – фаза отмирания.
1) латентную (лаг) фазу, в которой видимый рост инокулята не наблюдается ни по одному из критериев. При этом наблюдается высокая интенсивность дыхания, максимальные значения энергетического уровня, интенсивный синтез ДНК, РНК, белков и других компонентов клетки, но низкий митотический уровень. Длительность периода адаптации зависит от количества и физиологического состояния инокулята и условий культивирования; 2) экспоненциальную фазу, характеризующуюся ростом с максимальной скоростью, максимальными величинами митотической активности, а также преобладанием мелких клеток меристематического типа; 3) линейную, в течение которой скорость роста постоянна; 4) фазу замедленного роста, связанного с субстратным лимитированием и ингибированием продуктами обмена, и характеризующуюся несбалансированным ростом популяции по основным критериям, снижением уровня дыхания, переходом части клеток в дифференцированное состояние, увеличением доли крупных вакуолизированных клеток. Увеличением синтеза вторичных метаболитов (сердечных гликозидов, антрахинона, диосгенина); 5) стационарную фазу, характеризующуюся еще малой скоростью деградации клеток, которая уравновешивается делением клеток, высокими биосинтетическими и биотрансформирующими потенциями жизнеспособных дифференцированных клеток, низким уровнем дыхания и появлением чрезвычайно крупных вакуолизированных клеток; 6) фазу деградации клеток с удельной скоростью роста, принимающей отрицательное значение. Форма реальных ростовых кривых может значительно отличаться продолжительностью фаз от модельной. Процессы ростового цикла зависят от вида растения, количества внесенного материала и условий культивирования (состав питательной среды, температура, начальное значение рН, состав газовой фазы, скорость перемешивания). Первичный и вторичный метаболизм культивируемых клеток растений видоспецифичен, зависит от типа дифференцировки исходных клеток растения и регулируется условиями выращивания. Генетическая изменчивость клеток как следствие их культивирования вне организма, исчезновение одних и появление других стойких признаков, передающихся в ряду клеточных поколений, приводит к возникновению из первичной каллусной ткани генетически и фенотипически различающихся линий клеток. Это позволяет отобрать или создать экспериментально линии, сохраняющие биосинтетические системы, характерные для исходного растения, и линии, синтезирующие принципиально новые вещества.
Культивирование отдельных клеток Источником отдельных (одиночных) клеток являются клеточные суспензии в жидкой питательной среде, мацерация тканей растений, изолированные протопласты после восстановления ими клеточной стенки. Причем, изолированные протопласты являются идеальными отдельными клетками. Культивирование отдельных клеток позволяет получать клоны и исследовать генетическую и физиологическую стабильность или изменчивость при выращивании клонового материала. Отдельные клетки важны для клоновой селекции мутантных, гибридных, трансформированных линий. Обычно в эти клетки вводят маркерные гены или создают маркерные признаки для обеспечения селективных условий отбора. Мацерированные клетки ткани растения являются хорошей моделью для сравнительного изучения физиологических процессов в ткани и отдельной клетке. Вместе с тем при культивировании этих клеток на среде, стимулирующей деление клеток, они дифференцируются и образуют колонии каллусных клеток. Для получения отдельных мацерированных клеток используются специальные мацерирующие ферментативные препараты, содержащие мацеразу (полигалактуроназу), пектиназу, поливинилпирролидон, сульфат калия, сорбит (маннит), 2-N-морфолино-этансульфоновую кислоту. Данная процедура производится в ламинар-боксе в условиях строгой стерильности. Отдельные клетки также могут быть получены из суспензий с использованием микроманипулятора, проточного цитофлюориметра или путем последовательных разбавлений. В этом случае суспензии готовятся разными способами: 1) 1-2 мл суспензии отбирают из супернатанта после оседания основной массы клеток, 2) суспензию фильтруют через фильтры с уменьшающимся диаметром пор. Для последовательных разведений используют платы для микротитрований, что позволяет микроскопически контролировать клеточный состав при последовательных разведениях. Индукция делений отдельных клеток возможна при применении очень богатой питательной среды, причем объем среды должен быть минимальным. Однако даже при соблюдении всех этих условий процент разделившихся клеток остается очень низким. Более эффективны методы "кормящего слоя" или "ткани-няньки". Для создания "кормящего слоя" берут суспензию клеток того же вида растения. Клеточная суспензия должна находиться в ранней стадии ростового цикла. Каллусная культура, служащая "тканью-нянькой", также должна быть в стадии активного роста. При достижении колонией, выросшей из отдельной клетки, размера 0,5-1 мм, она может быть перенесена для дальнейшего выращивания на агаризованную питательную среду непосредственно либо на фильтр, помещенный на поверхность питательного агара. Использование "кормящего слоя", "ткани-няньки" или минимального объема среды, в которую помещается отдельная клетка, связаны с явлением, называемым "действие фактора кондиционирования". Несмотря на многочисленные попытки определить природу веществ, индуцирующих деление отдельной клетки, и механизм действия фактора кондиционирования, данный вопрос окончательно не решен. Изучение механизма взаимодействия клеток при размножении их в популяции - важная научная проблема, которая решается на уровне культивирования отдельных клеток.
Поиск по сайту: |