 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Принципы классической термодинамики
Термодинамика изучает свойства систем взаимодействующих объектов (тел или полей) путем количественного анализа превращений энергии, происходящих в системе. Классическая термодинамика сформировалась окончательно в середине XIX века в трудах Клаузиуса и Томсона и представляла собой механическую теорию теплоты. Со времен античности существовали две точки зрения на природу тепловых явлений. Греки видели в них либо проявление огня, как одного из первичных элементов мира, либо проявление общей идеи теплоты. В Новое время эти взгляды были представлены в виде теории теплорода, как особых частиц вещества, перетекающих от одного тела к другому, и в виде представления о теплоте, как некоем роде внутреннего движения в веществе. Обе точки зрения формально годились для описания почти всех тепловых явлений. Но ни одна из них не могла претендовать на роль окончательной теории, так как атомно-молекулярная структура вещества оставалась неизученной. Появление тепловых машин в XVIII-XIX веках потребовало теоретического обоснования их работы. Но только после того, как был определен механический эквивалент теплоты, оказалось возможным построить термодинамику макромира как науку на основе взаимосвязи между тепловой и другими видами энергии без привлечения какой-либо модели структуры вещества. Основные понятия термодинамики. Термодинамическая система – мысленно выделенная совокупность макрообъектов, которые обмениваются энергией в форме теплоты или работы друг с другом и с внешней средой. Изолированная система – такая система, в которой отсутствует обмен энергией и веществом с внешней средой. Состояние термодинамической системы определяется термодинамическими параметрами. Термодинамические параметры – физические величины, характеризующие свойства системы в целом (плотность, энергия, вязкость, давление). Уравнение состояния – связывает термодинамический параметр с параметрами, принятыми за независимые переменные (обычно давление р [Па], объем V [м3], температуру T [К] принимают за независимые переменные). Равновесное состояние – состояние, параметры которого не изменяются с течением времени при постоянных внешних условиях. Термодинамический процесс – изменение состояния системы, т.е. изменение значений параметров (например, Равновесный термодинамический процесс – процесс, который можно рассматривать как непрерывный ряд бесконечно близких равновесных состояний, т.е. параметры – непрерывные функции времени ( Обратимый термодинамический процесс – процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы во внешней среде остались какие-либо изменения. Очевидно, что все реальные тепловые процессы необратимы. Об обратимости можно говорить только в идеальном случае, когда процесс идет настолько медленно, что в каждый момент времени состояние системы является равновесным. Опыт показывает, что возможна передача энергии системе извне путем теплообмена в форме теплоты и путем силового воздействия в форме механической работы. Математически этот факт опыта обобщен в виде I начала термодинамики:
где
С – теплоемкость системы; V1, T1, U1 – параметры 1-го состояния (до передачи энергии); V2, T2, U2 – параметры 2-го состояния (после передачи энергии). Существенно, что, так как Опыт показывает, что все реальные термодинамические процессы необратимы, в то время как равенство 1) Клаузиус (1850): невозможен процесс, единственным результатом которого является совершение работы, эквивалентной количеству теплоты, полученному от нагревателя. 2) Томсон (1851): невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему. Математическое выражение II начала было дано Клаузиусом в виде: Здесь S – энтропия (превращение) – функция состояния, такая, что для любого обратимого процесса Очевидно, что для изолированной системы Таким образом, была предложена еще одна формулировка II начала термодинамики: 3) Клаузиус (1865): энтропия изолированной системы не может убывать при любых процессах в ней. Экспериментальное изучение свойств тел при 1) Постулат Планка (1911): Энтропия правильно сформированного кристалла чистого вещества Учитывая, что 2) Теорема Нернста (1906): Никакие реальные процессы не способны в принципе обеспечить достижение абсолютного нуля температур. Действительно, т.к. Таким образом, классическая термодинамика основана на трех началах, законах, обобщающих опытные факты; следствия их применения к конкретным системам дают практически значимые результаты.
Поиск по сайту: |
 или
или  ).
). ,
,  и т.д.).
и т.д.).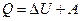 ,
,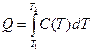 – теплота, переданная системе;
– теплота, переданная системе; – работа термодинамической системы;
– работа термодинамической системы; – изменение внутренней энергии системы U;
– изменение внутренней энергии системы U; и
и  – функции, характеризующие конкретный процесс,
– функции, характеризующие конкретный процесс,  и А зависят от вида процесса, а U не зависит от него и является только функцией состояния.
и А зависят от вида процесса, а U не зависит от него и является только функцией состояния. для любого процесса в изолированной системе.
для любого процесса в изолированной системе. , где
, где  – малое количество теплоты; тогда
– малое количество теплоты; тогда 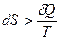 для любого необратимого процесса.
для любого необратимого процесса. .
.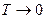 показало, что
показало, что 
 и что практически все вещества кристаллизуются в твердое состояние. Эти факты обобщены в виде III начала термодинамики. Вот две формулировки этого закона:
и что практически все вещества кристаллизуются в твердое состояние. Эти факты обобщены в виде III начала термодинамики. Вот две формулировки этого закона: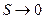 при
при  , можно однозначно определить
, можно однозначно определить  .
.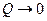 , что технически неосуществимо.
, что технически неосуществимо.