 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Образование 80S-комплекса инициации
II стадия ЭЛОНГАЦИИ ( включает 3 этапа) 1. связывание аминоацил-т-РНК (узнавание кодона) 2. образование пептидной связи 3. транслокация (перемещение рибосомы относительно м-РНК)
АУГ-ЦГА-ГЦУ-м- РНК АУГ-ЦГА-ГЦУ ГТФ ГДФ+Ф
Пептидилтрансфераза катализирует образование пептидной связи арг-мет
АУГ-ЦГА-ГЦУ АУГ-ЦГА-ГЦУ ГДФ+Ф ГТФ
1. Цикл начинается с введения аминоацил–т-РНК в пустой А-участок рибосомы. В зависимости от того, какой кодон м-РНК находится в А-участке выбирается определенная разновидность т-РНК. Комплиментарная аминоацил-т-РНК оставляется в А-участок фактором элонгации ЕF1. Когда аминоацил-т-РНК занимает правильное положение на рибосоме происходит гидролиз 1 молекулы ГТФ. 2. Т.о. имеется комплекс, в котором аминоацил-т-РНК занимает А-участок, а мет-т-РНК занимает Р-участок. Все готово к образованию пептидной связи. Эту реакцию катализирует пептидилтрансфераза, входящая в состав 60S-субъединицы. Активированная мет-т-РНК с Р-участка переносится на амино-группу аминоацил-т-РНК в А-участок, образуя дипептид т-РНК. После этого под действием фактора элонгации – транслоказы происходит сдвиг рибососмы по м-РНК на 3 нуклеотида, используя энергию ГТФ. В А-участке оказывается следующий кодон или триплет нуклеотидов, характерный для определенной АК. Дальнейшее удлинение цепи происходит путем многократного повторения этих процессов. Скорость элонгации довольно велика: пептид из 100 АК образуется ≈ за 2 мин. Остаток мет может отщепляться в ходе элонгации от цепи под действием специфической пептидгидролазы, а может и сохраниться в некоторых белках.
III стадия ТЕРМИНАЦИЯ. Удлинение пептидной цепи продолжается до тех пор пока А-участок не окажется занятым одним из стоп-кодонов УАА, УАГ, УГА. В этом случае при участии факторов терминации происходит гидролитическое взаимодействие между пептидом и последней т-РНК, а в цитоплазму высвобождается готовый белок. В результате трансляции не всегда образуется функционально активный белок. Во многих случаях необходимы дополнительные пострансляционные изменения.
Принципиальная схема биосинтеза белка (по А.С. Спирину).
ЛЕКЦИЯ 6 ФЕРМЕНТЫ Ферменты, или энзимы – это белковой природы, образующиеся и функционирующие во всех живых организмах. Слово фермент происходит от лат. fermentum – закваска, другое название ферментов – энзимы от греч. en zyme – в дрожжах. Впервые ферментативные процессы были открыты в бродильном производстве. Современная ферментология или энзимология– это наука о ферментах, их структурной организации. Она решает задачи изучения механизмов действия ферментов, путей регуляции ферментной активности. Такой интерес к биокатализаторам не случаен. Ферменты – это важнейшие компоненты клетки, без них невозможны синтез, распад и взаимопревращения в живых организмах. Через ферментный аппарат и регуляцию его активности происходит и регуляция скорости метаболических реакций. Изучение важно для биологии, медицины, фармации, многих областей народного хозяйства. Установлено, что многие заболевания человека связаны с нарушением деятельности ферментов, целый ряд ферментов является лекарственными препаратами. Общие и специфические свойства ферментов. Являясь катализаторами, то есть веществами, ускоряющими реакции, ферменты имеют ряд общих свойств с химическими небиологическими катализаторами. 1. Ферменты и входят в состав конечных Р и выходят из реакции в неизменном виде, они не расходуются в процессе катализа. 2. Ферменты не могут возбудить реакций, противоречащим законам термодинамики, они ускоряют только те реакции, которые могут протекать и без них. 3. Ферменты, как правило, не смещают положения равновесия реакции, а лишь ускоряют его достижение. Вместе с тем ферменты обладают и специфическими свойствами: 1. По химическому строению ферменты являются белками (>99,9). 2. Эффективность ферментов на несколько порядков выше, чем небиологических катализаторов. Например: H2O2 ® H2O + ½ O2 а) если реакция протекает без катализатора, то Еа = 75,7 кдж/моль, пузырьки О2 почти не видны; б) если прибавить катализатор небиологический то Еа = 54,1 кдж/моль, пузырьки отчетливо видны; в) если прибавить биологический катализатор каталазу, то Еа = 18 кдж/моль, раствор просто «кипит». 3. Высокая специфичность – каждый фермент катализирует одну единственную реакцию или одну группу реакций, тогда как неорганические катализаторы действуют при различных типах реакций. 4. Ферменты катализируют реакции в «мягких» условиях: при нормальном Р, рН = 7,0. Для неорганических катализаторов присуща необходимость экстремальных значений рН, нагревание до очень высоких температур. Химическая природа и строение ферментов. Важным доказательством белковой природы ферментов явились работы Пастера (инактивация ферментов брожения при кипячении), Павлова (доказал белковую природу пепсина – фермента желудочного сока) и т.д. 1) важный признак белковой природы ферментов – их большая Mr. Например, у ДГ Mr = 4 ´106; 4,8 ´105 и т.д. 2) растворы ферментов имеют коллоидный характер – они не проходят через полунепроницаемую мембрану, осаждаются из растворов теми же реактивами, что и белки; 3) ферменты денатурируют и теряют свою активность под влиянием высокой температуры, УЗ, сильных щелочей и других факторов; 4) ферменты, как и белки, обладают амфотерными свойствами, электрофоретической подвижностью и рI. 5) как и белки, ферменты обладают высокой специфичностью; 6) наконец, прямым доказательством белковой природы ферментов явился искусственный синтез ферментов (рибонуклеаза, лизоцим), которые не отличаются по свойствам и биологической активности от природных аналогов.
В ферментах-протеидах белковая часть называется апоферментом, а небелковая – простетической группой. Общее название сложных ферментов – холофермент. Если простетическая группа слабо связана с белковой частью и легко диссоциирует, она называется коферментом. Кофермент может соединяться с разными белками, и именно белковая часть определяет специфичность действия сложных ферментов. Вместе с тем, без кофермента сложный фермент не может функционировать, так как кофермент, как правило, непосредственно контактирует с субстратом (S) и служит в качестве переносчика ē, атомов или группы атомов. Кофакторы, или коферменты это: 1) ионы Me – Mg2+, Ca2+, Cu2+, Mn2+ b lh/$ 2) витамины и их фосфорные эфиры – витамин Н (биотин)(в составе коферментов карбоксилирования), липоевая, фолиевая кислоты, В1 и др.; 3) мононуклеотиды ФМН, АТФ, ГТФ и т.д.; 4) большая часть коферментов – это динуклеотиды НАД, НАДФ, HS-KoA и др. При гиповитаминозах и авитаминозах недостаток витаминов ослабляет биосинтез многих ферментов и вызывает гипокоферментоз. Коферменты выполняют также важную роль в стабилизации и охране апоферментов. Последние без коферментов скорее разрушаются протеолитическими ферментами. Таким образом, сами по себе ни коферменты, ни апоферменты каталитической активностью не обладают, а только в комплексе друг с другом. Молекулы S-в чаще всего имеют небольшие размеры по сравнению с молекулами ферментов, поэтому при образовании Е-S-го комплекса в контакт с S вступает ограниченная часть аминокислот ППЦ, которая называется активным центром (АЦФ). У Е-протеидов в состав АЦФ входят также и простетические группы. Таким образом, активный центр фермента – это уникальная комбинация аминокислотных остатков, обеспечивающих непосредственное взаимодействие Е и S и прямое участие в акте катализа.
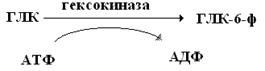
При сближении Е и S и образовании ЕS-комплекса нуклеофильные и электрофильные группы АЦФ, отдавая или принимая ē-ны, тем самым как бы «расшатывают» электронную структуру S, активируя его и ускоряя химическую реакцию. Есть ферменты, имеющие несколько АЦФ – уреаза–3; алкоголь ДГ–4; ацетилхолингетераза – 25-30 АЦФ у разных животных. Аллостерические центры ферментов. Кроме АЦФ, у ферментов имеются и аллостерические ( греч. allos – другой) или инопространственные центры. Это место воздействия на ферменты разных регуляторных факторов. Взаимосвязь между АЦФ и АЛЦФ называется аллостерическими взаимодействиями. Важная особенность АЛЦФ – их более высокая по сравнению с АЦФ чувствительность к различным воздействиям. Например, при повышении температуры и применении рН раньше затормаживается функция АЛЦФ. В частности, при повышении температуры аллостерический центр гексокиназы теряет чувствительность к регуляторному воздействию инсулина и глюкокортикоидов, а функциональная активность ферментов сохраняется и продолжает фосфорилировать глюкозу за счет АТФ.
Регуляторное воздействие на аллостерический центр оказывают: различные метаболиты ферментативных реакций, гормоны и продукты их обмена, медиаторы НС и т.д. Они называются эффекторами или модификаторами. Их молекулы не сходны с молекулами S-в. Связываясь с аллостерическим центром, эффекторы изменяют ТС и ЧС ферментов, тем самым изменяют конфигурацию АЦФ, что приводит к повышению (активированию) или понижению (ингибированию) ферментативной активности. Изоферменты – это молекулярные формы ферментов, возникающие вследствие генетических различий в ПС ферментного белка. Это группа ферментов, которые присутствуют внутри одного вида (ЛДГ) или внутри одной клетки (аминотрансферазы), имеют одинаковый механизм действия, но отличаются по некоторым физико-химическим свойствам: электрофоретической подвижности, иммунобиологическим реакциям. Например,
Поиск по сайту: |
 мет мет арг
мет мет арг




 Р-уч. А-уч фактор элонгации ЕF1, доставляет аминоацил-т-РНК
Р-уч. А-уч фактор элонгации ЕF1, доставляет аминоацил-т-РНК 









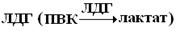 существует в виде пяти изоферментов. Хотя они катализируют одну и ту же реакцию, отличаются по своей Кт. У них одинаковая Mr (134.000) и по 4 ППЦ с Mr 33.500. Пять изоферментов соответствую пяти различным комбинациям двух разных типов ППЦ, названных M – (muscle) и H– (heart) цепями. Изофермент М4 – находится в мышечной ткани, содержит идентичные 4М-цепи; Н4 – находится в сердце, содержит идентичные 4Н-цепи. Остальные три изофермента – это различные сочетания М3Н; М2Н2; МН3. Два типа цепей – М и Н, кодируются двумя различными генами, сочетание ППЦ находится под генетическим контролем. Наличие изоферментов и изменение их соотношения в организме – один из способов регуляции ферментов.
существует в виде пяти изоферментов. Хотя они катализируют одну и ту же реакцию, отличаются по своей Кт. У них одинаковая Mr (134.000) и по 4 ППЦ с Mr 33.500. Пять изоферментов соответствую пяти различным комбинациям двух разных типов ППЦ, названных M – (muscle) и H– (heart) цепями. Изофермент М4 – находится в мышечной ткани, содержит идентичные 4М-цепи; Н4 – находится в сердце, содержит идентичные 4Н-цепи. Остальные три изофермента – это различные сочетания М3Н; М2Н2; МН3. Два типа цепей – М и Н, кодируются двумя различными генами, сочетание ППЦ находится под генетическим контролем. Наличие изоферментов и изменение их соотношения в организме – один из способов регуляции ферментов.