 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Основные положения простого метода МО Хюккеля
Простой метод Хюккеля был введён для π-электронных систем на самом раннем этапе развития квантовой химии. Он был предложен немецким учёным Хюккелем в 1931 г. Пережив в 30 – 40-е гг. период сравнительно широкого использования, он не потерял своего значения и по сей день по той причине, что в самой его структуре заложена способность правильно отражать симметрию молекулярных систем (что важно в понимании реакционной способности) и их топологию, т.е. последовательность соединения атомов, их близость или удалённость друг от друга и т.п. Простой метод МО Хюккеля вводится для сопряженных, так называемых π-электронных систем в π-электронном приближении. В этом случае от каждого атома, входящего в сопряжённую систему, берётся по одной pz‑орбитали с внешнего уровня, и молекулярная волновая функция записывается в виде Ψ = Коэффициенты при АО сν находят как решение системы из m уравнений Рутаана, при этом считается, что матричные элементы фокиана Fμν равны эффективному одноэлектронному гамильтониану Нμν (то есть в этом случае пренебрегают кулоновскими и обменными интегралами)
………………………
В ходе решения вышеприведённой системы уравнений можно получить соответственно m собственных значений орбитальных энергий и m молекулярных орбиталей. Все pz-орбитали считаются ортогональными, то есть интегралы перекрывания Sμν в случае μ = ν равны единице, в случае μ ≠ ν Sμν = 0 (Sμν= δμν) (Приближение НДП). Параметризация матричных элементов Нμν осуществляется следующим образом. Для диагональных матричных элементов Нμμ
α + δμ·β - для гетероатомов . Для недиагональных матричных элементов Нμμ в случае соседних атомов
β + kμν·β - атом углерода соседствует с гетероатомом
В случае несоседних атомов Нμν = 0. В вышеприведенных соотношениях величина α приравнивается к потенциалу ионизации pz-орбитали атома углерода. Величина β берётся в зависимости от параметризации из экспериментальных термохимических или спектроскопических данных (причём всегда β<0). Величины δμ, kμν для гетероатомов называются параметрами Стрейтвизера, они также определяются из экспериментальных данных и в настоящее время табулированы. Таким образом, метод полностью параметризован. После подстановки значений Нμν и Sμν в уравнение (1.24) получают систему уравнений Хюккеля и решают ее. Предполагается, что в полную волновую функцию входят лишь те орбитали, которые имеют низшие орбитальные энергии, то есть заполнение π-орбиталей производится в порядке возрастания их энергий. Полная энергия системы, относящаяся к π-электронной подсистеме (π‑электронная энергия), вычисляется как сумма соответствующих орбитальных энергий с учётом чисел заполнения для каждой орбитали (ni = 2, 1, 0): Etot = Eπ = Заряд на атоме qν (число π-электронов на атоме ν) и порядок π-связи между атомами μ и ν (Pμν) определяются соответственно как qν = Pμν = Две последние величины могут быть использованы не только для оценки реакционной способности, дипольных моментов, но и для определения длин связей Rμν с применением эмпирических соотношений. Например, для расчёта длин углерод‑углеродных связей можно использовать соотношение Rμν = 0,1517 ‑ 0,018·Pμν (нм). Простой метод Хюккеля является, пожалуй, самым несложным в освоении. Однако качественно (иногда даже полуколичественно) он верно передаёт основные свойства непредельных систем. А используемые в нём выражения для определения зарядов и порядков связей не сильно отличаются от расчётных схем, применяющихся в других квантово-химических методах.
Поиск по сайту: |
 сνχν, где χν – атомные орбитали pz-электронов. (1.23)
сνχν, где χν – атомные орбитали pz-электронов. (1.23)
 сν (Нν1 ‑ εSν1) = 0
сν (Нν1 ‑ εSν1) = 0 α - для атомов углерода ;
α - для атомов углерода ;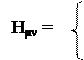 β - для атомов углерода ;
β - для атомов углерода ; ni·εi . (1.25)
ni·εi . (1.25)