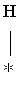|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Катализаторах риформинга
Алюмоплатиновые катализаторы риформинга являются бифункциональными. Металлические центры катализируют реакции окислительно-восстановительного характера. Кислотные центры носителя осуществляют превращения углеводородов по ионному механизму. Активные центры могут проявлять как самостоятельное, так и совместное действие. На металлических центрах протекают реакции гидрирования-дегидрирования различных углеводородов, гидроизомеризация, гидрогенолиз. На кислотных центрах происходят различные реакции изомеризации, процессы полимеризации и гидрокрекинга. Химические превращения углеводородов начинаются с адсорбции. Хемосорбционные связи могут быть ковалентными или ионными.
2.1.1. Реакции на металлических центрах Процессы гидрирования-дегидрирования обычны для парафинов, нафтенов, олефинов, диенов, ароматических углеводородов. С2Н4 + Н2 « С2Н6
Механизм реакции включает хемосорбцию обоих реагентов, за которой следует реакция. Н2 хемосорбируется на двух атомах металла с разрывом связи Н-Н (диссоциативная адсорбция). Олефин может адсорбироваться на одном атоме металла с помощью p-взаимодействия:
Более общепринята теория диссоциативной адсорбции этилена на двух атомах металла с образованием s-связей
Н2 + 2 *
Реакции дегидрирования, протекающие по этому же механизму в обратном направлении, приводят к образованию кокса и самоотравлению катализатора. При гидрировании атомы водорода на поверхности присоединяются к адсорбированному олефину в две стадии. Вначале (2.3) образуется адсорбированный алкильный радикал. Имеется достаточно доказательств существования такого «полугидрированного» состояния по данным ИК - спектров. Элементарные реакции (1.2) и (1.3) обратимы. Это подтверждается данными дейтерообмена: в продуктах реакции С2Н4 и D2 обнаружены не только дейтероэтаны, но и дейтероэтилены, и даже C2D4 и C2D6. Дегидрирование циклогексана и его гомологов. Реакция имеет нулевой порядок по циклогексану и по водороду при температуре < 3700С, т.е. не зависит от концентраций циклогексана и водорода. По-видимому, в этих условиях лимитирующей стадией реакции является десорбция бензола с поверхности катализатора, или другая медленная стадия – в зависимости от механизма. Механизм реакции заключается в адсорбции циклогексана и одновременной или очень быстрой диссоциации шести связей С-Н. Ступенчатый механизм допускает возможность реберной ориентации шестичленного цикла на дублетном активном центре платинового катализатора. Дегидрирование циклогексана проходит через стадии образования различных адсорбированных промежуточных комплексов:
Отщепление одного атома водорода и образование Н-* ведет к моноадсорбированной частице С6Н11, затем образуется p-связанный олефин и p-связанные аллильные комплексы. В конечном счете образуется бензол. В обратном направлении эта схема дает представление о гидрировании бензола. Скорость дегидрирования циклогексена и циклогексадиена намного выше, чем циклогексана. Лимитирующей стадией является
С6Н12 адс. ® С6Н10 адс. + Н2 Т.к. следующие стадии протекают быстро, в продуктах реакции промежуточные соединения не обнаружены. При малых степенях превращения циклогексана (от 3 до 30 %) при объемных скоростях 1000 – 18000 ч-1 были обнаружены заметные количества циклогексена – от 0,001 до 0,029 %. Алкилциклопентаны и циклогексаны с блокированными положениями (гем-диалкилы, спирановые и мостиковые) не дегидрируются с образованием диенов при температурах, при которых циклогексановые углеводороды быстро дегидрируются на Pt. Такие блокированные соединения дегидрируются при более высоких температурах, когда начинают протекать внутримолекулярные и межмолекулярные перегруппировки. [Гейтс 326]. Изомеризация, дегидроциклизация, гидрогенолиз. Изомеризация может протекать на металлических центрах: 1. СН3–СН2-СН2-СН2-СН2–СН3 + 5*
2.
3. Повторная адсорбция циклической частицы:
4.
Схема изомеризации парафина С6 на металлическом центре приведена на рис. 2.1.
Р и с. 2.1. Схема изомеризации С6- парафина на поверхности металла. I – пятичленное кольцо на поверхности
Замыкание шестичленного цикла также происходит, но ведет не к изомеризации, а к циклизации. Далее реакция
протекает очень быстро. В продуктах реакции не был обнаружен 2, 2 -диметилбутан, что также подтверждает предложенную схему. Исследованиями с использованием меченых атомов 13С в различных положениях была показана возможность изомеризации путем сдвига связи. Возможна миграция алкильной группы в адсорбированной фазе без образования цикла:
Эта возможность была показана в исследовании с использованием меченых атомов углерода (рис. 2.2).
Р и с. 2.2. Схема изомеризации со сдвигом связи С-С (1) и с промежуточным образованием пятичленного цикла (2) ● – меченый атом углерода.
В другом исследовании (рис. 2.3) показано, что при 2400С раскрытие цикла сопровождается миграцией СН3 – групп (1), а при 2300С – не сопровождается (2).
Р и с. 2.3. Схема изомеризации метилциклопентана ● – меченый атом углерода
Гидрогенолиз (разрыв связи С-С) на никелевом катализаторе обычно протекает с образованием СН4 и небольшого количества С2Н6. На платиновом катализаторе предпочтительным является разрыв связи С-С ближе к центру молекулы. Механизм гидрогенолиза включает адсорбцию смежных атомов углерода на смежных атомах металла с разрывом С-Н связей. Для того, чтобы произошел разрыв связей С-С, атомы углерода должны быть подвергнуты дальнейшей дегидрогенизации:
Когда связь С-С рвется, происходит повторная гидрогенизация фрагментов.
2.1.2. Реакции, катализируемые оксидом алюминия Изомеризация. На оксиде алюминия изомеризация протекает по карбоний-ионному механизму. Скелетная изомеризация парафинов намного более затруднена, чем изомеризация соответствующих олефинов. Изомеризация парафинов возможна лишь на сильнокислотных катализаторах или при высоких температурах. Следы олефинов заметно ускоряют изомеризацию парафинов. Схема изомеризации на бифункциональном алюмоплатиновом катализаторе: М 1) н-парафин
к.ц. 2) н-олефин
М 3) изоолефин + Н2 Перегруппировка олефина протекает на кислотных центрах носителя:
R – CH = CH – CH2 – CH3 + H+
CH3 │ R – CH2 – HC+ – CH2 – CH3
CH3 CH3 │ │
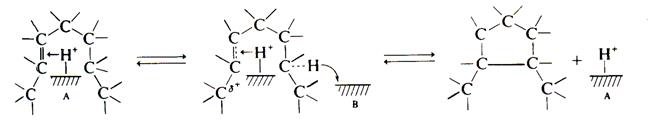
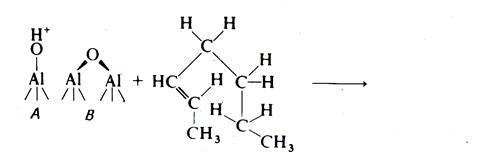
CH3 │ R – CН – CH2 – CH3 Олефины могут циклизоваться на кислотных центрах. Предположительный механизм: циклизация протекает согласованно на соседних кислотно-основных центрах носителя. Происходит протонирование двойной связи кислотным центром Бренстеда и одновременный отрыв протона от атома углерода в цепи (А – кислотный центр, В – основной центр):
Следует ожидать, что эта реакция протекает на соседней паре кислотно-основных центров на поверхности катализатора:
В отличие от гидрогенолиза, гидрокрекинг – одна из основных реакций каталитического риформинга. В результате гидрокрекинга снижается средняя молярная масса н-парафинов, что ведет к повышению октанового числа. В отличие от гидрогенолиза, гидрокрекинг протекает по бифункциональному механизму с использованием кислотных центров катализатора. М 1) н-парафин ® н-олефин + Н2
2)Адсорбция на кислотном центре + СН3-СН=СН-СН2-СН2- СН3 + Н+ ® СН3- СН2-СН-СН2-СН2- СН3
4) либо превращение вторичного карбкатиона в более устойчивый третичный изомер; либо распад:
+ + СН3- СН2-СН-СН2-СН2- СН3 ® СН3- СН2 + СН3- СН2-СН=СН2 Крекинг происходит преимущественно по b-связи по отношению к атому углерода с положительным зарядом. 5) Гидрирование олефинов на металлических центрах. Ароматизация парафинов. Это сложный процесс, включающий ряд последовательных и параллельных реакций. Дегидрирование парафинов до олефинов протекает очень быстро. В условиях риформинга концентрация олефинов соответствует равновесной. Это важно, т.к. олефины – промежуточные продукты в ароматизации парафинов. Возможные схемы реакции:
1) н-С6Н14 ® С=С-С-С-С-С ® С=С-С=С-С-С ® С=С-С=С-С=С ® ® циклогексадиен ® бензол До 34 % бензола образуется по этому механизму.
2) До 50 % бензола получается из н-С6Н14 без десорбции промежуточных продуктов реакции.
3) Существует бифункциональный механизм реакции: дегидрирование происходит на металлических центрах, циклизация – на кислотных. За счет этого механизма получается от 30 до 60 % бензола.
2.1.3. Коксообразование В процессе риформирования на поверхности плптинового катализатора отлагаются продукты уплотнения и конденсации различных углеводородов. Предполагается, что одним из путей образования кокса при риформинге такой сложной углеводородной смеси, как бензиновая фракция, может быть частичное дегидрирование некоторых углеводородов до лабильных диенов с последующим возникновением полимеров, экранирующих активные центры катализатора. Такими углеводородами могут быть пятичленные цикланы, способные дегидрироваться с образованием углеводородов ряда циклопентадиена, весьма склонных к полимеризации. Ниже приведена схема образования продуктов уплотнения углеводородов на алюмоплатиновом катализаторе, согласно которой продукты уплотнения состоят из производных пятичленных циклических ненасыщенных углеводородов неупорядоченной структуры:
Зональное размещение кокса на поверхности алюмоплатинового катализатора и различие каталитического действия платины и носителя приводят к заключению, что процессы образования кокса на платине и носителе должны различаться. Можно предположить, что образовавшиеся на платине непредельные и ароматические углеводороды подвергаются на носителе ряду кислотно-катализируемых реакций (полимеризации, циклизации, конденсации), которые в результате многостадийных превращений приводят к отложению кокса. Хотя состав кокса может значительно отличаться, полагают, что в основном он состоит из дефицитных по водороду моно- и полициклических ароматических колец, связанных с алифатическими и алициклическими фрагментами. При всем различии механизмов коксообразования на платине и носителе (оксиде алюминия) действие их является взаимосвязанным. Ненасыщенные углеводороды, образующиеся на платине, служат источником кокса, отлагающегося на носителе. Возможно также мигрирование углеродсодержащих соединений с платины на носитель. С другой стороны, продукты уплотнения, в частности многоядерные ароматические углеводороды, образующиеся под действием кислотных центров носителя, достаточно подвижны и могут блокировать также металлические центры катализатора. Об их подвижности можно судить по тому, что при риформинге в жестких условиях в полученном бензине обнаружен полициклический ароматический углеводород коронен С24Н12. Таким образом, на процесс коксообразования влияют обе функции катализатора – металлическая и кислотная. Степень дезактивации катализатора должна зависеть от закоксованности как платины, так и носителя, поскольку ряд важнейших реакций риформинга протекает по бифункциональному механизму.
Лекция 12.
Поиск по сайту: |

 2
2  (2.1)
(2.1)



 + 3
+ 3