 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сущность каталитического действия
Катализ обусловлен промежуточным химическим взаимодействием реагирующих веществ с катализатором, в результате которого открывается новый реакционный путь. Ускорение процессов с помощью катализаторов достигается за счет того, что появляются новые механизмы, при которых медленные стадии заменяются более быстрыми. Реакция превращения веществ А и В в вещество АВ с участием катализатора К осуществляется по следующей схеме:
A + K® AK АК + В ® АВ + К ------------------------------------- А + В ® АВ.
Независимо от механизма действия роль катализатора с точки зрения энергетики реакции сводится, как показано на рис. 9, к снижению энергии активации (Еакат < Еа ), за счет чего увеличивается константа скорости реакции.
Рис.9. Реакция с участием катализатора
Катализатор может также способствовать необходимой для взаимодействия молекул ориентации. Катализатор не влияет на константу химического равновесия и не смещает положение химического равновесия. Энергия активации прямой и обратной реакций при введении катализатора уменьшается на одинаковую величину. Катализатор ускоряет прямую и обратную реакции, т.е. сокращает время достижения равновесия при подходе к нему как со стороны исходных веществ, так и со стороны продуктов.
Гомогенный катализ
Гомогенным называют катализ, при котором катализатор и реагирующие вещества находятся в одной фазе (газовой или жидкой). Примером гомогенногогазофазного каталитического процесса может служить окисление диоксида серы SO2 до триоксида SO3. Без катализатора диоксид серы очень медленно окисляется кислородом. При производстве серной кислоты камерным способом процесс окисления диоксида серы до триоксида катализируется оксидом азота (II), который открывает для реакции новый путь, не включающий медленной стадии взаимодействия диоксида серы с молекулярным кислородом 2 SO2 (г) + О2 (г)
Катализатор NO вступает в реакцию с кислородом О2 , образуя промежуточный продукт NO2, 2NO (г) + O2 (г) = 2NO2(г) .
NO2 затем реагирует с SO2 по реакции 2SO2 (г) + 2NO2 (г) = 2SO3 (г) + 2NO (г), в результате которой получается конечный продукт и выделяется катализатор в химически неизменном виде и первоначальном количестве. К преимуществам гомогенного катализа можно отнести высокую эффективность действия катализаторов, так как реакция идет во всем объеме сосуда. Но практическое выделение продуктов из реакционной смеси может быть затруднено. Гетерогенный катализ
Гетерогенным называют катализ, при котором катализатор и реагирующие вещества находятся в разных фазах. Процесс идет на границе раздела фаз. Обычно катализатор представляет собой твердое вещество, а реагенты находятся в газе или жидкости. Механизмы действия гетерогенных катализаторов включают в себя следующие основные стадии: 1) движение реагирующих веществ к поверхности катализатора; 2) адсорбцию реагентов поверхностью катализатора; 3) взаимодействие реагентов на поверхности; 4) десорбцию продуктов реакции с освобождением поверхности катализатора; 5) отвод продуктов реакции из реакционной зоны. В зависимости от условий проведения процесса и его особенностей лимитирующей может оказаться любая из этих стадий. Адсорбция может способствовать разрыхлению и поляризации определенных химических связей, активировать реагирующие молекулы, обеспечивая на поверхности катализатора их благоприятную взаимную ориентацию в течение времени, необходимого для взаимодействия. Активность гетерогенного катализатора зависит от величины и свойств его поверхности. Количество активных центров (участков, на которых обеспечиваются оптимальные условия реакции) определяется составом поверхностного слоя, способом приготовления катализатора и обработки его поверхности. Обычно применяют тонко измельченные порошки, пористые структуры с высокоразвитой поверхностью, в том числе пористые носители с нанесенным слоем катализатора. Во многих случаях гетерогенный катализ протекает с помощью переходных металлов и их соединений (Pt, Pd, Rh, Fe, Ni, CuO, V2O5, NiO, Fe2O3, Cr2O3 и др.). Примерами гетерогенного катализа являются вышерассмотренная реакция окисления диоксида серы SO2 до триоксида SO3, но уже в присутствии твердого катализатора V2O5 или Pt 2SO2(г) + O2(г) или реакция синтеза аммиака N2 (г) + 3H2 (г) Гетерогенный катализ удобен тем, что катализатор не смешивается с реагентами, поэтому не возникает проблемы отделения его от продуктов реакции. Но с течением времени активная поверхность твердых катализаторов может измениться.
Химическое равновесие Состояние равновесия
Реакции, протекающие при одних и тех же условиях одновременно в противоположных направлениях, называются обратимыми. Рассмотрим простую обратимую реакцию, которая протекает в закрытой системе A + B « C + D. Скорость прямой реакции описывается уравнением
где С течением времени концентрации реагентов А и В уменьшаются, скорость реакции снижается (рис.10, кривая
Рис.10. Изменение скоростей прямой и обратной реакций во времени
Реакция между А и В приводит к образованию веществ C и D, молекулы которых при столкновениях могут вновь дать вещества А и В. Скорость обратной реакции описывается уравнением
где По мере того как концентрации веществ C и D возрастают, скорость обратной реакции увеличивается (рис.10, кривая В какой-то момент времени скорости прямой и обратной реакций становятся равными
Такое состояние системы называется состоянием равновесия. В состоянии равновесия концентрации всех его участников перестают меняться во времени. Такие концентрации называются равновесными. Химическое равновесие – это динамическое равновесие. Неизменность концентраций веществ, присутствующих в закрытой системе, есть следствие непрерывно идущих химических процессов. Скорости прямой и обратной реакций не равны нулю, а нулю равна наблюдаемая скорость процесса. Равенство скоростей прямой и обратной реакций – это кинетическое условие химического равновесия. Константа равновесия
При равенстве скоростей прямой и обратной реакций
справедливо равенство
где [A], [B], [С], [D] – равновесные концентрации веществ. Поскольку константы скоростей не зависят от концентраций, равенство можно записать иначе:
Отношение констант скоростей прямой и обратной реакций (
Рассмотрим сложную реакцию aA + bB « cC + dD Любую сложную химическую реакцию можно представить в виде ряда простых реакций. Для каждой из простых реакций можно записать кинетическое уравнение прямой и обратной реакций и соответствующие им выражения для констант равновесия. Константа равновесия сложной реакции равна произведению констант равновесия простых реакций, описывающих ее механизм
Поэтому в суммарное выражение для константы равновесия равновесные концентрации войдут в степенях их стехиометрических коэффициентов
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе. Концентрации твердых веществ не входят в выражение константы равновесия гетерогенной реакции. Например, выражение для константы равновесия следующей реакции СО2 (г) + С(тв) « 2СО(г) записывается так:
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Численное значение константы равновесия определяет, каким должно быть соотношение концентраций всех реагирующих веществ при равновесии. Изменение концентрации любого из этих веществ влечет за собой изменение концентраций всех остальных веществ. В итоге устанавливаются новые равновесные концентрации, но соотношение между ними вновь соответствует константе равновесия. Величина константы равновесия зависит от природы реагирующих веществ и температуры. Константа равновесия, выраженная через молярные концентрации реагирующих веществ
где Dn - изменение числа газообразных молей в реакции. Стандартное изменение энергии Гиббса равно
а также
После приравнивания правых частей уравнений
или
Уравнение (4.3) не только устанавливает вид зависимости константы от температуры, но и показывает, что константа определяется природой реагирующих веществ. Константа равновесия не зависит от концентраций реагентов (как и константа скорости реакции), механизма реакции, энергии активации, от присутствия катализаторов. Смена механизма, например, при введении катализатора не влияет на численное значение константы равновесия, но может изменить скорость достижения равновесного состояния.
Поиск по сайту: |

 2 SO3 (г).
2 SO3 (г). 2SO3(г)
2SO3(г) 2 NH3 (г).
2 NH3 (г).
 ,
, – скорость прямой реакции;
– скорость прямой реакции;  – константа скорости прямой реакции.
– константа скорости прямой реакции.
 ,
, – скорость обратной реакции;
– скорость обратной реакции;  – константа скорости обратной реакции.
– константа скорости обратной реакции.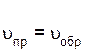 .
. ,
, .
. .
.
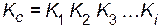 .
. .
.

 .
. и константа равновесия, выраженная через равновесные парциальные давления
и константа равновесия, выраженная через равновесные парциальные давления  (см. «Основы химической термодинамики»), связаны между собой соотношениями
(см. «Основы химической термодинамики»), связаны между собой соотношениями ;
;  ,
, ,
, .
.
 .
.