 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Реакции от концентрации реагирующих веществ
Чтобы произошло химическое взаимодействие, необходимо столкновение реагирующих частиц. При одной и той же температуре количество столкновений растет с увеличением количества реагирующих частиц в единице объема, т.е. с возрастанием концентрации реагентов. Соответственно, скорость реакции повышается с увеличением концентрации реагирующих веществ. Выведенное на основе экспериментальных данных уравнение, выражающее зависимость скорости от концентраций реагирующих веществ, показывает, что скорость химической реакции пропорциональна произведению концентраций реагентов в степенях, называемых порядками реакции по реагентам и определяемых опытным путем. Уравнение, устанавливающее зависимость скорости от концентрации реагирующих веществ, называется дифференциальным кинетическим уравнением реакции. Например, для реакции аА + bB = cC + dD выражение для скорости реакции будет иметь следующий вид:
где k – коэффициент пропорциональности, называемый константой скорости реакции; [A] и [B] - молярные концентрации реагирующих веществ; n и m - показатели степеней при концентрациях реагентов (порядки реакции по веществам А и B). Общим порядком, или просто порядком реакции, называется величина, равная сумме показателей степеней при концентрациях реагентов в кинетическом уравнении реакции (n+m). Порядок реакции равен сумме порядков по реагирующим веществам. Константа скорости k – постоянная величина (при T = const) и не зависит от концентрации реагентов. Она определяется природой реагирующих веществ и зависит от температуры. Из уравнения (2.3) следует, что при единичных концентрациях реагирующих веществ (например, [A] = [B] = 1 моль/л) константа скорости реакции численно равна скорости реакции. Из этого же уравнения видно, что размерность константы скорости реакции зависит от порядка реакции, поскольку размерность скорости реакции для всех гомогенных реакций одинакова. Единицу измерения константы скорости реакции определяют из анализа размерностей. Порядок реакции зависит от ее сложности. Для простой (элементарной) реакции стехиометрическое уравнение передает механизм процесса, стехиометрические коэффициенты уравнения реакции совпадают с порядками по реагентам, молекулярность совпадает с общим кинетическим порядком. Для необратимой элементарной реакции зависимость скорости от концентрации реагентов выражается законом действующих масс. При постоянной температуре скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам. Рассмотрим необратимые элементарные реакции разного вида и применим к ним закон действующих масс. 1. Скорость реакции первого порядка А ® продукты, характеризуется кинетическим уравнением
Константа скорости реакции первого порядка имеет размерность [с-1].
Например, для термораспада диметилового эфира CH3OCH3 ® CH4 + H2 + CO,
2. Скорость реакции второго порядка в соответствии с законом действующих масс равна: 2А ® продукты, А + В ® продукты, Размерность константы скорости реакции второго порядка [л· моль-1·с-1]. Например, для реакции разложения иодида водорода 2 HI ® H2 + I2
Или, для реакции этерификации уксусной кислоты этанолом CH3COOH + C2H5OH ® CH3COOC2H5 + H2O,
3. Скорость реакции третьего порядка A + B + C ® продукты, 2A + B ® продукты, 3A ® продукты, Размерность константы скорости третьего порядка [л²· моль-2·с-1]. Например, реакция взаимодействия оксида азота с хлором 2NO + Cl 2 ® 2NOCl,
Закон действующих масс справедлив только для элементарных реакций. В большинстве случаев реакции многостадийны. Для сложных (многостадийных) реакций порядки реакции по реагентам не совпадают со стехиометрическими коэффициентами, общий порядок реакции не равен сумме стехиометрических коэффициентов.
Порядок сложной реакции может быть целым, дробным числом и даже равным нулю. Порядок сложной реакции определяют экспериментально. Например, реакция: 2N2O5 = 2N2O4 + O2 является сложной и протекает по стадиям:
Наиболее медленно протекает стадия (а), т.е. эта стадия является лимитирующей. Скорость стадии (а) и соответственно всей сложной реакции будет равна
Так, приведенная выше сложная реакция имеет первый порядок по оксиду азота (V) и общий первый порядок.
Поиск по сайту: |

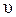 = k [A].
= k [A].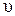 = k [CH3OCH3]
= k [CH3OCH3]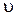 »
»  =
= 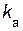 [N2O5].
[N2O5].