 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Реакции второго порядка
Для реакций второго порядка, если реагенты имеют одинаковые концентрации, кинетическое уравнение имеет вид
После разделения переменных и интегрирования получим
и
Отсюда следует, что для реакции второго порядка должна соблюдаться прямолинейная зависимость между величиной 1/С и временем, а так же, что время полураспада зависит от начальной концентрации:
Итак основная задача определить k, но прежде чем использовать любое уравнение необходимо убедиться, что данная реакция имеет именно тот порядок, которому соответствует это уравнение. Поэтому первейшая задача определить порядок реакции. Размерность k: Поскольку размерность скорости не зависимо от порядка реакции есть [C][t-1], то размерность k для реакций 1-го порядка [t-1]; для реакций 2-го порядка – [C-1][t-1] и для реакций 3-го порядка – [C-2][t-1]. Концентрацию С в химической кинетики принято выражать либо в молекулах в 1см3 , либо в молях на литр. Соответственно этому: k 1-го порядка – сек-1; k 2-го порядка – см3/с или л/моль с; k 3-го порядка – см6/с или см3/моль2с. МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ Метод подстановки: Заключается в подстановке экспериментальных данных ( t, t1, t2,t3; С0, С1, С2, С3) последовательно в уравнения кинетики реакции 0,1,2 и 3 порядков и определении, какое из них приводит к постоянному значению k. Порядок будет такой, какая формула дает лучшее постоянство k для различного времени.
Графический метод определения порядка реакции: Заключается в построении графика выражающего зависимость различных функций С от t. Чтобы определить порядок необходимо получить прямую линию функции. В случае реакции 1-го порядка линейную зависимость от t дает lgC. В случае реакции 2-го порядка – 1/С от t и для реакции 3-го порядка – 1/С2 от t. Для реакции нулевого порядка С от t дает параллельные прямые оси абсцисс. Другой способ графического определения порядка реакции: Порядок реакции определяется по зависимости скорости реакции w от текущей концентрации реагирующего вещества L:
       , ,
Рис.1. Аналитические методы определения порядка реакции: а) Порядок реакции определяется по начальной скорости реакции (метод Вант-Гоффа):
где б) Порядок реакции определяется по времени ta’ и ta’’ одинаковой степени превращения a при начальных концентрациях Co’ и Co’’:
Лекция 3
Поиск по сайту: |
 (27)
(27) (28)
(28) (29)
(29)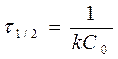 (30)
(30)



 ,
,


 a = lg k
a = lg k 







 - начальные скорости реакции при начальных концентрациях
- начальные скорости реакции при начальных концентрациях  .
.