 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
КИНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Химические реакции разделяют или по признаку молекулярности или по признаку порядка. Молекулярность – определяется числом молекул, одновременно участвующих в химическом акте. Если превращение испытывает одна молекула, то реакция называется мономолекулярной, если в процессе участвуют две молекулы - бимолекулярной и т.д. Так как вероятность одновременного столкновения большого числа частиц мала, молекулярность одностадийного процесса не превышает трех. Тримолекулярные реакции встречаются редко. Реакций более высокой молекулярности практически неизвестно. Если реакция показывает, что в процессе участвует большее число молекул, следовательно процесс идет более сложным путем – через несколько стадий последовательно протекающих реакций, в каждой из которых участвует 2 молекулы, редко 3. Это сложные реакции и их рассматривают как совокупность последовательных или параллельных реакций. Мономолекулярные реакции – реакции разложения молекул и внутримолекулярных перегруппировок. F2 = 2F и 2F = F2
здесь CF – концентрация исходного вещества. K – имеет размерность [t-1],с1. Бимолекулярная реакция H2 + F2 = 2HF
[C]= моль/л, [k] = 1/моль с/л = л/мольс Тримолекулярная реакция А + В + С = АВС
Размерность [k] = 1/[t][C2] = t-1C-2 ; C = моль/см3 ; [k] = см6/смоль2
ПОРЯДОК РЕАКЦИИ
Химические реакции редко протекают в одну стадию, как их принято записывать в учебниках химии. В обычной одностадийной записи уравнений химических реакций указывается только начальное и конечное состояние системы, что является, по существу символическим выражением материального баланса (закона сохранения вещества). В действительности реакция обычно протекает через ряд промежуточных стадий, причем скорость реакции определяется скоростью наиболее медленной стадии. В тех случаях, когда реакция протекает в одну стадию (такая реакция называется элементарным химическим процессом), порядок реакции ni по данному веществу i совпадает со стехиометрическим коэффициентом данного вещества в химическом уравнении. Алгебраическая сумма показателей степеней n = n1 + n2 есть суммарный порядок реакции. Общий порядок элементарной химической реакции равен сумме стехиометрических коэффициентов веществ, вступающих в реакцию, или, другими словами, числу молекул, участвующих в реакции. Например, рассмотрим распад перекиси водорода, согласно уравнению реакции,
должен протекать как реакция второго порядка, на самом деле порядок этой реакции изменяется в зависимости от условий ее проведения и может быть первым или дробным. Последнее, таким образом, указывает на то, что реакция протекает через различные промежуточные стадии. В применении к гетерогенным процессам различают истинный и кажущийся порядок реакции. Истинный порядок – порядок реакции относительно концентрации компонента участвующего на поверхности твердой фазы. Кажущийся порядок – порядок реакции зависит от соотношения между объемной и поверхностной концентрациями. Кинетическому уравнению с этой точки зрения отвечает кажущийся порядок. Величина наблюдаемого (кажущегося) на опыте порядка реакции может зависеть от условий эксперимента. Например, если опыт проводится в избытке одного из компонентов, таким образом изменение его концентрации и влияние на скорость будет незаметным. Тогда nкаж = 0 по данному компоненту.
РЕАКЦИИ 1ГО ПОРЯДКА Гомогенные реакции К ним относятся мономолекулярные реакции, например реакции разложения молекул и реакции внутримолекулярных перегруппировок. F2 = 2F Те же кинетические уравнения применимы к процессам радиоактивного распада. Чтобы получить зависимость концентрации от времени, следует проинтегрировать это уравнение, разделив переменные и взяв в качестве пределов C = C0 при t = 0 и при t = t:
Отсюда Отсюда Из уравнения (21) следует, что константа скорости реакции первого порядка имеет размерность [t-1] и, следовательно, ее численное значение не зависит от единиц, которыми измеряется концентрация. Как следует из уравнения (22), концентрация экспоненциально уменьшается со временем, прошедшим с начала реакции (кривая 2 на рис.1). Уравнение (20) может быть представлено в виде :
Таким образом, в реакциях первого порядка логарифм концентрации находится в линейной зависимости от времени (прямая на рисунке).
Если опытные данные укладываются на прямую линию в координатах lnC - t в широком интервале концентраций, то это может служить доказательством того, что рассматриваемая реакция идет по первому порядку. Часто уравнение (20) используют в несколько иной форме; при этом вводят концентрацию x образовавшегося к моменту t продукта реакции и обозначают через a начальную концентрацию C0. В этом случае
Для характеристики реакции часто вместе с величиной константы скорости пользуются величиной времени полупревращения t1/2, т.е. времени в течение которого претерпевает превращение половина исходного вещества. Очевидно, для реакций первого порядка
не зависит от исходной концентрации. Отсюда вытекает следующее уравнение
Эти соотношения показывают, что k реакции 1-го порядка обратно пропорциональна периоду полураспада. (Используется для процессов р.а. распада).
Поиск по сайту: |

 (11 и 12)
(11 и 12)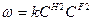
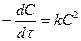 при СH2=CF2=1 Размерность K [k]=t-1c-1 (13 и 14)
при СH2=CF2=1 Размерность K [k]=t-1c-1 (13 и 14) при CA= CB = CC = C
при CA= CB = CC = C 
 (15,16 и 17)
(15,16 и 17)
 (18)
(18) (19)
(19) или
или  . (20 и 21)
. (20 и 21) . (22)
. (22)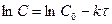 (23)
(23)
 (24)
(24) (25)
(25) (26)
(26)