 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
В. Синапсы с АК медиаторами
Главные медиаторы головного мозга – АК. Главное для мозга – не содержание и действие одного медиатора, а баланс возбуждающих и тормозящих регуляторов. ТОРМОЗНЫЕ: ГАМК является главным тормозным медиатором в нервной системе. Она увеличивает проницаемость постсинаптических мембран для ионов калия и тем самым отдаляет мембранный потенциал от порогового уровня, при котором возникает потенциал действия. Инактивация ГАМК осуществляется путем трансаминирования. Постсинаптический ГАМК-рецептор может связываться с фенобарбиталом, вальпроатом и бензодиазепинами. Глицин — основной тормозной медиатор в спинном мозгу и большинстве структур ствола мозга. Торможение осуществляется в результате повышения проводимости постсинаптической мембраны для Сl–, что приводит к ее гиперполяризации. Основной антагонист рецепторов глицина – стрихнин, отравление которым прекращает действие глицина, и эффекты возбуждающих АК-медиаторов становятся преобладающими, что приводит к судорогам. Индолилалкиламины образуются из триптофана. 1) Серотонин образуется из 5-гидрокситриптофана в пресинаптических серотонинергических нейронах преимущественно в клетках ретикулярной формации и в энтерохромаффинных клетках кишечника. Серотонин связывается с постсинаптическим гидрокситриптофановым рецептором. Медиатор регулирует вегетативные функции. Снижает агрессивность, страх, депрессию, стимулирует пищевое поведение, сон, впадение в спячку, снижает болевые рефлексы, способствует обучению, лидерству, снижает половую активность при гиперфункции. 2) Меланотонин образуется в эпифизе тоже из триптофана. Освобождается ночью и способствует сну, тормозит выделение гонадотропинов, снижает половую активность. возбуждающиЕ: Глутамат возбуждающий медиатор, как и АХ.Действует через быстрые ионотропные каналы (тонус, бодрствование, все виды активности, обучение, память, чувствительные и болевые импульсы). Слишком большим освобождением этого медиатора в синапс обусловлена эпилепсия, поэтому для достижения баланса большинство противоэпилептических лекарств, так или иначе стимулируют ГАМК-эргическую систему. Возбудитель столбняка образует токсин, выключающий ГАМК, поэтому возбуждающие АК не встречают противодействия и вызывают перевозбуждение до судорог и смерти. При ишемии в синапс освобождается так много глутамата, что он вызывает в постсинаптическом нейроне чрезмерное накопление Са2+ – до нейротоксических концентраций, и возникает инсульт (инвалидизация – речь, интеллект, моторика мышц…). Аспартат
СПЕЦИАЛИЗИРОВАННЫЕ медиаторы. 1) В качестве нейротрансмиттера может выступать аденозин (основная функция – нейромодулятор ингибирования). Кофеин чая и кофе блокирует рецепторы аденозина и вызывает прилив бодрости. Нейротрансмиттерами могут быть и другиепроизводные пурина – АМФ, АДФ, АТФ. 2) Из прогестерона в мозге образуются активирующие нейростероиды,которые действуют через активацию ГАМК-рецепторов нейронов. Вызывают перед месячными предменструальный синдром с раздражительностью и т.д. 3) значительная доля безмиелиновых волокон содержит нейропептиды,которые накапливаются в мелких гранулах: субстанция Р, опиоидные пептиды, соматостатин, ВИП - вазоактивный интестинальный пептид, нейропептиды Y и K, холецистокинин и др. СТОМ Пептидергические аксоны выявлены в нервных стволиках коронковой и корневой пульпы, в сплетении Рашкова, в периферическом слое пульпы среди одонтобластов. Многие пептидергические волокна связаны здесь с кровеносными сосудами различных размеров. Пептидергические волокна в пульпе участвуют в регуляции кровотока, обеспечивают болевую чувствительность, регулируют выделение различных нейромедиаторов, влияют на развитие воспаления. субстанция Р – болевая чувствительность. Есть мнение, что безмиелиновые волокна несут только сигналы, которые воспринимаются как тупая, точно не локализованная боль. эндогенные опиоидные пептиды (эндорфины, энкефалины, динорфины) –участвуют в интеграции и ограничении сенсорной информации, имеющей отношение к боли. 4) NO и СО, АФК. Гематоэнцефалический барьер (ГЭБ)— физиологический барьер, препятствующий смешиванию крови и спинномозговой жидкости (СМЖ). ГЭБ проницаем для воды, но не для электролитов. Для уравновешивания в СМЖ концентраций Na+ и К+ после изменения их концентраций в крови требуется не один час. Перенос веществ через ГЭБ зависит от молекулярной массы, связи с белками, липофильности (у альбуминов соотношение плазма крови:СМЖ=0:1). Связанные с белками ионы, билирубин, лекарства и др.вещества не проникают через ГЭБ. Например, в крови 90% препарата фенитоина связано с белками, а 10% — несвязанный фенитоин, который проникает через ГЭБ и оказывает терапевтический эффект. Проницаемость ГЭБ нарушается при воспалении, травме, опухоли, ишемии, действии токсинов. Спинномозговая жидкость.Функции: механическая защита мозга, удаление продуктов метаболизма из мозга, транспорт биологически активных веществ. Общий объем СМЖ 150 мл, плотность — 1,006-1,008, рН = 7,31, содержание белков 200-400 мг/л, глюкозы 2,5-4,44 ммоль/л, натрия 138-150 ммоль/л, калия 2,7-3,9 ммоль/л. Равновесие между глюкозой крови и глюкозой СМЖ устанавливается за 4 ч. При спинномозговой пункции требуется одновременная оценка уровня глюкозы в крови и СМЖ. Белки проникают в СМЖ из плазмы крови путем пиноцитоза через эндотелий капилляров. ЛИЦЕВАЯ БОЛЬ (+дополнительно патофиз) Международная ассоциация по изучению боли (IASP) определяет: боль – неприятное ощущение и эмоциональное переживание, связанное с реальным или потенциальным повреждением ткани. Боль выполняет защитную функцию, являясь "сигналом" опасности. Боль физиологична,пока информирует о повреждении. Как только сигнальная функция боли исчерпывается, она уже не нужна. Если болевые раздражения продолжают поступать в ЦНС, боль становится патологической, причиняет вред организму, постепенно нарушая его многие функции. Залог успешной борьбы с болью – понимание ее сущности. Представления о механизмах появления боли были обобщены в 2-х основных теориях. Обе теории – две стороны единого целого. 1) Теория интенсивности (Goldscheider, 1894). Отрицается существование специальных болевых рецепторов. Боль могут вызвать разные достаточно сильные раздражители при стимуляции обычных сенсорных рецепторов (механо-, термо-, хемо-, фото-), если интенсивность стимуляции превосходит обычный уровень и достигает определенного критического уровня. Рецепторы генерируют импульсы, отличающиеся от импульсов при действии слабых раздражителей. Импульсацию распознает ЦНС, возникает ощущение боли. В 1955 году характер такой импульсации пыталась объяснить теория распределения импульсов, или теория паттерна (англ. pattern – модель, устойчивая последовательность элементов): болевые стимулы вызывают особый порядок следования импульсов, отличный от разрядов, вызываемых другими раздражителями. 2) Теория специфичности противоположна теории интенсивности (M.Frey, 1894): признает существование специализированных болевых рецепторов – ноцицепторов (от лат. посеrе – повреждать и receptor – принимающий), которые отвечают только на интенсивные стимулы, возникающие при повреждающих воздействиях. Они составляют 25-40% всех рецепторов, расположены по всему телу, за исключением головного мозга и, возможно, костной ткани. СТОМ Из тканей челюстно-лицевой области больше всего болевых рецепторов в тканях зуба. Так, на 1см2 дентина – 15 000-30 000 ноцицепторов, на границе пульпы и дентина – до 75 000, а на 1см2 кожи не более 200 болевых рецепторов. Выражена болевая чувствительностью у пульпы, её ноцицепторы с очень низким порогом чувствительности и их раздражение вызывает болевое ощущение исключительной силы. 3 типа рецепторов боли. Первый тип – мономодальные(от лат. modus – способ), возбуждаются интенсивными механическими раздражениями (в меньшей степени термическими), поэтому их называют механоноцицепторами(илиА-δ-ноцицепторами – по типу нервных волокон). Порог для их стимулов выше нормального диапазона обычных механорецепторов, они активируются только сверхсильными раздражителями. Расположены преимущественно в коже, скелетных мышцах, фасциях, сухожилиях, суставных сумках, слизистых пищеварительного тракта. Второй тип – полимодальные С-ноцицепторы (тельца безмиелиновых афферентных С-волокон) реагируют на механические, температурные и химические раздражения. Называют хемоноцицепторами, т.к. активируются 1) химическими веществами — алгогенами (высвобождаются при повреждении тканей и вызывают боль): тканевыми (серотонин, ацетилхолин, гистамин, простагландины Е2, F2α, D2, лейкотриены, избыток Н+, К+) и плазменными (брадикинин). Хемоноцицепторы расположены в коже и слизистых оболочках, во внутренних органах, где локализуются в стенках мелких артерий. В развитии болевого сигнала также участвуют 2) медиаторы боли. Нейромедиаторы ноцицептивных афферентных волокон – глутаминовая и аспарагиновая аминокислоты. Но основной нейропередатчик – вещество Р (от англ. pain – боль). Оно действует в зоне формирования болевого импульса и на всех участках его передачи.Важное значение в формированиигенераторов патологических возбужденийв структурах ЦНС, связанных с переработкой ноцицептивныхвозбуждений,имеетдефицит тормозных процессов, которые опосредуют глицин и γ-аминомасляная кислота. Третий тип – так называемые "спящие" ноцицепторы, они активизируются только во время воспаления. Как и хемоноцицепторы, они представлены плотными некапсулированными гломерулярными тельцами С-волокон. Общее для всех типов ноцицепторов: 1) активируются при действии раздражителей большой силы 2) изменчивость порога возбуждения. Величина порога чувствительности ноцицепторов зависит от многих факторов – их локализации, наследственных особенностей, эмоционального и соматического состояния организма. На уровне задних рогов спинного мозга болевая афферентация подвергается начальному анализу и может быть даже заблокирована. R. Melzack, P. Wall (1965) сформулировали теорию "входных ворот" – одну из наиболее плодотворных концепций механизмов боли. Основное научно-медицинское значение теории: в организме существуют специальные системы подавления боли, а спинной и головной мозг является активной системой, фильтрующей, отбирающей и воздействующей на входные сенсорные сигналы. Теория утвердила центральную нервную систему ведущим звеном в болевых процессах, в то время как теория специфичности отводила центральной нервной системе роль пассивного приёмника болевых импульсов. Пути проведения ноцицептивной информации формируют 2 системы: 1) специфическую лемнисковую (спиноталамический тракт заднего столба спинного мозга) Первая система представлена быстропроводящими А-волокнами и заканчивается в первой соматосенсорной зоне коры головного мозга, где формируется острая, точно локализованная боль. Её основная задача – обеспечить мозг немедленной информацией о наличии и степени повреждения, а также его локализации. Вторая система представлена тонкими немиелинизированными С-волокнами, она проводит возбуждение к таламусу и второй соматосенсорной зоне коры больших полушарий. При этом возникает диффузная, постоянная боль, призванная ограничить активность поврежденного органа, а также формируются двигательные, вегетативные, эмоциональные реакции на боль. Характер возникающих болевых ощущений зависит не только от состояния ноцицептивной системы организма, но и от антиноцицептивной системы – обеспечивает контроль за активностью структур, участвующих в восприятии, проведении и анализе болевых сигналов. В результате происходит торможение спинальных, стволовых, таламических нейронов, передающих импульсы от болевых рецепторов. Антиноцицептивная система – Это многокомпонентная эндогенная система подавления боли: 1) структуры спинного, ствола мозга и коры, прежде всего её второй соматосенсорные зоны, в которых формируются эфферентные ответы на болевые импульсы; 2)нервные пути, по которым из центральных нервных структур приходят эфферентные сигналы, возбуждающие выделение химических модуляторов в синаптических зонах и в местах формирования болевого сигнала; 3)нейромедиаторы – химические вещества различной природы, тропные к соответствующим рецепторам и обладающие способностью блокировать или модулировать (изменять) болевые импульсы; 4)рецепторный аппарат – различные типы рецепторов, на которые воздействуют разные нейромедиаторы для модуляции болевой информации. В механизме ограничения болевого возбуждения участвуют системы мозга: · серотонинергическая, · норадренергическая, · ГАМКергическая · Опиоидергическая Важнейшее значение отводится опиоидергической системе. Термином «опиоиды» называют любые вещества (природные и синтетические), способные взаимодействовать с опиатными рецепторами (ОР). Все известные эндогенные опиоиды – пептиды. Их назвали опиоидными из-за способности связываться с теми же рецепторами, которые связывают морфин и другие опиаты. По ХИМИЧЕСКОМУ СТРОЕНИЮ лиганды ОР бывают: 1). Алкалоидные (основной представитель – морфин – открыт в 1805 г.), Опиоидные рецепторы есть во всех областях спинного и головного мозга, участвующих в передаче болевой информации (желатинозная субстанция спинного мозга, гипоталамус, лимбические структуры и кора мозга, ретикулярная формация). Существуют 3 основных типа ОР — μ-(мю), κ- (каппа) и δ- (дельта) рецепторы, каждый из которых взаимодействует с определенными нейропептидами, в результате чего снижается болевая чувствительность. Для связывания с опиатными рецепторами в составе реагирующей молекулы необходимо структурное присутствие хинолиновой кислоты, М.м=167,1 (пиридин-2,3-дикарбоновой – бензольное кольцо, где атом С1 заменен на N, а к атомам С2 и С3 присоединены кислотные (карбоновые) группировки).
–COОН N Хинолиновая кислота Впроцессеметаболизма этанола при полимеризации ацетальдегида с медиаторами образуются морфиноподобные продукты: бета-карболины,
В структуре опия (морфина) и ОП присутствует тирамин. Структурные формулы и общая конфигурация активного центра, участвующего в связывании морфина, налоксона, опиоидных пептидов с ОР:
НО Морфин–ЛЕЙ–ОН NH2 Мет(Лей)-энкефалин
В организме вырабатывается три группы эндогенных опиоидов – эндорфины, энкефалины и динорфины. Первыми были открыты энкефалины – два пентапептида мет-энкефалин и лей-энкефалин (остальные четыре аминокислоты одинаковые Тир-Гли-Гли-Фен-Мет/Лей). В гипоталамусе позже обнаружили более длинные (15-30 АК) опиоидные пептиды — α-, β-, γ-эндорфины, которые оказались в 12-100 раз активнее энкефалинов. Третья группа – динорфины. Опиоидные пептиды участвуют в обезболивании, в регуляции эмоциональных ответов, обладают антистрессорными свойствами, вырабатываются при мышечной работе. Опиоиды синтезируются не только в нервной ткани (в том числе локализованной в пульпе – в периферическом слое пульпы среди одонтобластов есть волокна, содержащие вещество Р), но и в надпочечниках, сердце (энкефалины). Особый интерес к этим соединениям и их синтетическим аналогам связан с надеждой найти анальгетики, к которым не возникает привыкания.
Поиск по сайту: |

 –COOH
–COOH

 НО HO
НО HO

 _СН2–СН2–NH2
_СН2–СН2–NH2











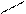 _СН2–СН–СО–ГЛИ–ГЛИ–ФЕН–МЕТ–ОН
_СН2–СН–СО–ГЛИ–ГЛИ–ФЕН–МЕТ–ОН
 О Налоксон (налоксан)
О Налоксон (налоксан)

