|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Энергетика мозга и глюкоза
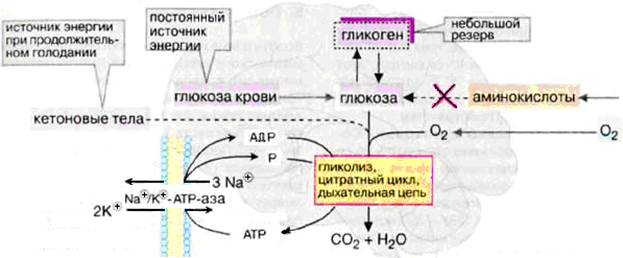
Интенсивность обновления богатых энергией фосфорных соединений в головном мозгу очень велика, поэтому содержание АТФ и креатинфосфата в мозговой ткани очень постоянно. Полное прекращение доступа кислорода (даже на 10-15 сек при нарушении кровоснабжения мозга) повреждает энергетику нервных клеток. Это выражается обморочными состояниями. При нормальных условиях энергетические потребности зрелого мозга обеспечиваются почти полностью за счет аэробного гликолиза. У человека масса мозга составляет 2 % от массы тела, но на долю мозга (в состоянии покоя) приходится ≈20 % потребления О2 и ≈60 % глюкозы. Зависимость головного мозга от глюкозы означает, что резкое падение уровня глюкозы в крови, например, в случае передозировки инсулина у диабетиков, может стать опасным для жизни. Поступление глюкозы в нейроны обеспечивает мембраный белок-переносчик GLUT-3 с низкой величиной Кт (1-2 ммоль/л). Мозг эффективно поглощает глюкозу из крови и окисляет со скоростью 75 мг за 1 мин. Во всём головном мозге содержится около 750 мг глюкозы, чего хватает на 10 мин жизни, поскольку мозгу нужен постоянный приток глюкозы. Окисление глюкозы в ткани мозга до СO2 и Н2O на 90 % происходит при участии цикла Кребса и дыхательной цепи, а также путем гликолиза.
Рис.Энергетический обмен в головном мозге При кислородном голодании головной мозг может получать энергию за счет процессов гликолиза очень недолго, так как содержание глюкозы в нем невелико. Запасы гликогена в клетках головного мозга незначительны. Жирные кислоты, которые в плазме крови транспортируются в виде комплекса с альбумином, не достигают клеток головного мозга из-за гематоэнцефалического барьера. Аминокислоты не могут служить источником энергии для синтеза АТФ, поскольку в нейронах отсутствует глюконеогенез. Только при продолжительном голодании клетки начинают использовать дополнительный источник энергии – кетоновые тела. В пренатальный и неонатальный периоды (т.е. перед рождением и в ранние сроки после рождения), а также у голодающих (независимо от возраста) на долю окисляемого ацетоацетата может приходиться ¼ потребляемого кислорода. В связи с тем, что аэробные превращения глюкозы – главный источник энергии, важное значение приобретает реакция окислительного декарбоксилирования пирувата. Считают, что полиневриты и другие неврологические признаки недостаточности витамина В1 (значит и дефицита кофермента ТДФ) – следствие неадекватного превращения пирувата в ацетил-КоА. В результате пируват накапливается, а его высокие концентрации токсичны для нервной системы. В клетках ЦНС до 40 % АТФ потребляет транспортная Na+/К+-АТФазаклеточных мембран. Активный транспорт Na+ и К+ компенсирует постоянный поток ионов через ионные каналы, необходимый для создания электрических потенциалов. Кроме того, АТФ используется для биосинтезов. СЕМЕЙСТВО БЕЛКОВ: Натрий-водородный противопереносчик(Na+/H+-АТФаза мембран, белок NHE) регулятор внутриклеточного рН, участвует: n NНЕ5 — регулятор рН и объема клеток в ЦНС: участие в механизмах защиты от набухания и отёка мозга n NНЕ4 — клетки слизистой желудка: участие в секреции HCI. n NHE3 — апикальные отделы плазматических мембран эпителия кишечника и почек. n NНЕ2 — канальцы почек и слизистой кишечника. n NHЕ1 — на всех клетках, кодируется геном SLC9A1. Именно дефект этого гена и данного белка ведет к развитию эссенциальной гипертензии. С ним связано развитие всех проявлений метаболического Х-синдрома (гипертензии, диабета, ожирения, гиперурикемии, атеросклероза).
Поиск по сайту: |