 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Структурно-морфологические особенности мышц⇐ ПредыдущаяСтр 31 из 31
Учение о мышцах - очень важный и интересный раздел биохимии. Исключительное значение этот раздел имеет для спортивной биохимии. Важнейшей особенностью функционирования мышц является то, что в процессе мышечного сокращения происходит преобразование химической энергии АТФ непосредственно в механическую энергию сокращения и движения. Это явление свойственно только живым организмам. Изучение механизма мышечной деятельности является проблемой не только биохимической. Достижения последних лет в этой области связаны с интеграцией биохимических, биофизических и электронно-микроскопических исследований строения и функционирования мышц. В настоящее время мышца рассматривается как высокоэффективная, универсальная машина, значительно превосходящая по техническим характеристикам все машины, созданные человеком. У животных и человека имеются два основных типа мышц: поперечно-полосатые и гладкие. Поперечно-полосатые мышцы прикрепляются к костям, т. е. к скелету, и поэтому еще называются скелетными. Поперечно-полосатые мышечные волокна составляют также основу сердечной мышцы — миокарда, хотя имеются определенные различия в строении миокарда и скелетных мышц. Гладкие мышцы образуют мускулатуру стенок кровеносных сосудов, кишечника, пронизывают ткани внутренних органов и кожу. Каждая поперечно-полосатая мышца состоит из нескольких тысяч волокон, объединенных соединительнотканными прослойками и такой же оболочкой - фасцией. Мышечные волокна (миоциты) представляют собою сильно вытянутые многоядерные клетки крупного размера длиной от 0,1 до 2-3 см, а в некоторых мышцах даже более 10 см. Толщина мышечных клеток около 0,1-0,2 мм. Как и любая клетка, миоцит содержит такие обязательные органоиды, как ядра, митохондрии, рибосомы, цитоплазматическую сеть и клеточную оболочку. Особенностью миоцитов, отличающих их от других клеток, является наличие сократительных элементов - миофибрилл. Ядра окружены оболочкой - нуклеолеммой и состоят в основном из нуклеопротеидов. В ядре содержится генетическая информация для синтеза белков. Рибосомы - внутриклеточные образования, являющиеся по химическому составу нуклеопротеидами. На рибосомах происходит синтез белков. Митохондрии - микроскопические пузырьки размером до 2-3 мкм, окруженные двойной мембраной. В митохондриях протекает окисление углеводов, жиров и аминокислот до углекислого газа и воды с использованием молекулярного кислорода (кислорода воздуха). За счет энергии, выделяющейся при окислении, в митохондриях осуществляется синтез АТФ. В тренированных мышцах митохондрии многочисленны и располагаются вдоль миофибрилл. Лизосомы - микроскопические пузырьки, содержащие гидролитические ферменты, расщепляющие белки, нуклеиновые кислоты и некоторые полисахариды. Цитоплазматическая сеть (саркоплазматическая сеть, саркоплаз- матический ретикулум) состоит из трубочек, канальцев и пузырьков, образованных мембранами и соединенных друг с другом. Саркоплазматическая сеть с помощью особых трубочек, называемых Т-системой, связана с оболочкой мышечной клетки - сарколеммой. Особо следует выделить в саркоплазматической сети пузырьки, называемые цистернами и содержащие в большой концентрации ионы кальция. В цистернах содержание ионов Са2+ примерно в тысячу раз выше, чем в цитозо- ле. Такой высокий градиент концентрации ионов кальция возникает вследствие функционирования фермента - кальциевой аденозинтри- фосфатазы (кальциевая АТФаза), встроенного в стенку цистерны. Этот фермент катализирует гидролиз АТФ и за счет выделяющейся при этом энергии обеспечивает перенос ионов кальция вовнутрь цистерн. Такой Механизм транспорта ионов кальция образно называется кальциевым насосом, или кальциевой помпой. Цитоплазма (цитозоль, саркоплазма) занимает внутреннее пространство миоцитов и представляет собой коллоидный раствор, содержащий белки, гликоген, жировые капли и другие включения. На долю белков саркоплазмы приходится 25-30% от всех белков мышц. Среди саркогшазматических белков имеются активные ферменты. К ним в первую очередь следует отнести ферменты гликолиза, расщепляющие гликоген или глюкозу до пировиноградной или молочной кислоты. Еще один важный фермент саркоплазмы - креатинкина- за, участвующий в энергообеспечении мышечной работы. Особого внимания заслуживает белок саркоплазмы миоглобин, который по строению идентичен одной из субъединиц белка крови - гемоглобина. Состоит миоглобин из одного полипептида и одного гема. Молекулярная масса миоглобина - 17 кДа. Функция миоглобина заключается в связывании молекулярного кислорода. Благодаря этому белку в мышечной ткани создается определенный запас кислорода. В последние годы установлена еще одна функция миоглобина - это перенос 02 от сарколеммы к мышечным митохондриям. Кроме белков в саркоплазме имеются небелковые азотсодержащие вещества. Их называют, в отличие от белков, экстрактивными веществами, так как они легко экстрагируются водой. Среди них - аденидовые нуклеотиды АТФ, АДФ, АМФ и другие нуклеотиды, причем преобладает АТФ. Концентрация АТФ в покое примерно 4-5 ммоль/кг. К экстрактивным веществам также относятся креатинфосфат, его предшественник - креатин - и продукт необратимого распада креатинфосфата - креатинин. В покое концентрация креатинфосфата обычно 15-25 ммоль/кг. Из аминокислот в большом количестве имеются глутаминовая кислота и глутамин. Основной углевод мышечной ткани - гликоген. Концентрация гликогена колеблется в пределах 0,2-3%. Свободная глюкоза в саркоплазме содержится в очень малой концентрации - имеются лишь ее следы. В процессе мышечной работы в саркоплазме происходит накопление продуктов углеводного обмена - лактата и пирувата. Протоплазматический жир связан с белками и имеется в концентрации 1%. Запасной жир накапливается в мышцах, тренируемых на выносливость. Каждое мышечное волокно окружено клеточной оболочкой - сарколеммой. Сарколемма представляет собою липопротеидную мембрану толщиной около 10 нм. Снаружи сарколемма окружена сетью из переплетенных нитей белка коллагена. При мышечном сокращении в коллагеновой оболочке возникают упругие силы, за счет которых при расслаблении мышечное волокно растягивается и возвращается в исходное состояние. К сарколемме подходят окончания двигательных нервов. Место контакта нервного окончания с сарколеммой называется нервно-мышечный синапс, или концевая нервная пластинка. Сократительные элементы - миофибриллы - занимают большую часть объема мышечных клеток, их диаметр около 1 мкм. В нетренированных мышцах миофибриллы расположены рассеянно, а в тренированных они сгруппированы в пучки, называемые полями Конгейма. Микроскопическое изучение строения миофибрилл показало, что они состоят из чередующихся светлых и темных участков, или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую под микроскопом поперечную исчертан- ность всего мышечного волокна (рис. 9).
Использование электронного микроскопа с очень большим увеличением позволило расшифровать строение миофибрилл и установить причины наличия у них светлых и темных участков. Было обнаружено, что миофибриллы являются сложными структурами, построенными, в свою очередь, из большого числа мышечных нитей (протофибрилл, или филаментов) двух типов - толстых и тонких. Толстые нити имеют Диаметр 15 нм, тонкие - 7 нм. Состоят же миофибриллы из чередующихся пучков параллельно Расположенных толстых и тонких нитей, которые концами заходят дРУг в друга. На рис. 10 представлена схема строения миофибриллы. А-диск Рис. 10. Схема строения миофибриллы Участок миофибриллы, состоящий из толстых нитей и находящихся между ними концов тонких нитей, обладает двойным лучепреломлением. При микроскопии этот участок задерживает видимый свет или поток электронов (при использовании электронного микроскопа) и поэтому кажется темным. Такие участки получили название анизотропные, или темные, диски (А-диски). Светлые участки миофибрилл состоят из центральных частей тонких нитей. Они сравнительно легко пропускают лучи света или поток электронов, так как не обладают двойным лучепреломлением и называются изотропными, или светлыми, дисками (I-диски). В середине пучка тонких нитей поперечно располагается тонкая пластинка из белка, которая фиксирует положение мышечных нитей в пространстве. Эта пластинка хорошо видна под микроскопом в виде линии, идущей поперек I-диска, и названа Z-пластинкой, или Z-линией (см. рис. 9 и 10). Участок миофибриллы между соседними Z-линиями получил название саркомер. Его длина 2,5-3 мкм. Каждая миофибрилла состоит из нескольких сотен саркомеров (до 1000). Изучение химического состава миофибрилл показало, что толстые и тонкие нити состоят только из белков. Толстые нити состоят из белка миозина. Миозин - белок с молекулярной массой около 500 кДа, содержащий две очень длинные полипептидные цепи. Эти цепи образуют двойную спираль, но на одном конце эти нити расходятся и формируют шаровидное образование - глобулярную головку. Поэтому в молекуле миозина различают две части - глобулярную головку и хвост (рис. 11).
116 В состав толстой нити входит около 300 миозиновых молекул, а на поперечном срезе толстой нити обнаруживается 18 молекул миозина. 1у1иозиновые молекулы в толстых нитях переплетаются своими хвостами, а их головки выступают из толстой нити по правильной спирали
В головках миозина имеются два важных участка (центра). Один из них катализирует гидролитическое расщепление АТФ, т. е. соответствует активному центру фермента. АТФазная активность миозина впервые обнаружена отечественными биохимиками Энгельгардтом и Любимовой. Второй участок головки миозина обеспечивает во время мышечного сокращения связь толстых нитей с белком тонких нитей - актином. Тонкие нити состоят из трех белков: актина, тропонина и тропо- миозина. Основной белок тонких нитей - актин. Актин - глобулярный белок с молекулярной массой 42 кДа. Этот белок обладает двумя важнейшими свойствами. Во-первых, проявляет высокую способность к полимеризации с образованием длинных цепей, называемых фибриллярным актином (можно сравнить с нитью бус). Во-вторых, как уже отмечалось, актин может соединяться с миозиновыми головками, что приводит к образованию между тонкими и толстыми нитями поперечных мостиков, или спаек. Основой тонкой нити является двойная спираль из двух цепей фибриллярного актина, содержащая около 300 молекул глобулярного актина (как бы две нити бус, закрученные в двойную спираль. Каждая бусинка соответствует глобулярному актину). На рис. 13 приведена схема строения двойной спирали из нитей фибриллярного актина.
Еще один белок тонких нитей - тропомиозин - также имеет форму Двойной спирали, но эта спираль образована полипептидными цепями и по размеру гораздо меньше двойной спирали актина. Тропомиозин располагается в желобке двойной спирали фибриллярного актина. Третий белок тонких нитей — тропонин - присоединяется к тропомиозину и фиксирует его положение в желобке актина, при котором блокируется взаимодействие миозиновых головок с молекулами глобулярного актина тонких нитей (рис. 14).
Мышечное сокращение является сложным механохимическим процессом, в ходе которого происходит преобразование химической энергии гидролитического расщепления АТФ в механическую работу, совершаемую мышцей. В настоящее время этот механизм еще полностью не раскрыт. Но достоверно известно следующее: 1. Источником энергии, необходимой для мышечной работы является АТФ. 2. Гидролиз АТФ, сопровождающийся выделением энергии, катализируется миозином, который, как уже отмечалось, обладает ферментативной активностью. 3. Пусковым механизмом мышечного сокращения является повышение концентрации ионов Са2+ в саркоплазме миоцитов, вызываемое двигательным нервным импульсом. 4. Во время мышечного сокращения между толстыми и тонкими нитями миофибрилл возникают поперечные мостики, или спайки. 5. Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом. Имеется много гипотез, пытающихся объяснить молекулярный механизм мышечного сокращения. Наиболее обоснованной в настоящее время является гипотеза «весельной лодки», или «гребная» гипотеза X. Хаксли. В упрощенном виде ее суть заключается в следующем. В мышце, находящейся в состоянии покоя, толстые и тонкие нити миофибрилл друг с другом не соединены, так как участки связывания на молекулах актина закрыты молекулами тропомиозина. Мышечное сокращение происходит под воздействием двигательного нервного импульса, представляющего собой волну повышенной мембранной проницаемости, распространяющуюся по нервному волокну • Эта волна повышенной проницаемости передается через нервно-мышечный синапс на Т-систему саркоплазматической сети и в конечном счете достигает цистерн, содержащих ионы кальция в большой концентрации. В результате значительного повышения проницаемости стенки цистерн (это тоже мембрана!) ионы кальция выходят из цистерн и их концентрация в саркоплазме за очень короткое время (около 3 мс) возрастает с 10~8 до КГ5 г-ион/л, т. е. в 1000 раз. Ионы кальция, находясь в высокой концентрации, присоединяются к белку тонких нитей - тропонину - и меняют его пространственную форму (конформацию). Изменение конформации тропонина, в свою очередь, приводит к тому, что молекулы тропомиозина смещаются вдоль желобка фибриллярного актина, составляющего основу тонких нитей, и освобождают тот участок актиновых молекул, который предназначен для связывания с миозиновыми головками. В результате этого между миозином и актином (т. е. между толстыми и тонкими нитями) возникает поперечный мостик, расположенный под углом 90°. Поскольку в толстые и тонкие нити входит большое число молекул миозина и актина (около 300 в каждую), то между мышечными нитями образуется довольно большое количество поперечных мостиков, или спаек. На электронной микрофотографии (рис. 15) хорошо видно, что между толстыми и тонкими нитями имеется большое количество поперечно расположенных мостиков.
Нервное вотокно состойi ич аксонов - отростков нервных клеюк собой гр\бочки, обргнованные и\ плазмашческои мембраной. Образование связи между актином и миозином сопровождается повышением АТФазной активности последнего (т. е. актин действует подобно аллостерическим активаторам ферментов), в результате чего происходит гидролиз АТФ: АТФ + Н20 -------- АДФ + Н3Р04 + энергия За счет энергии, выделяющейся при расщеплении АТФ, миозиновая головка, подобно шарниру или веслу лодки, поворачивается и мостик между толстыми и тонкими нитями оказывается под углом 45°, что приводит к скольжению мышечных нитей навстречу друг другу (рис. 16).
Совершив поворот, мостики между толстыми и тонкими нитями разрываются. АТФазная активность миозина вследствие этого резко снижается, и гидролиз АТФ прекращается. Но если двигательный нервный импульс продолжает поступать в мышцу и в саркоплазме сохраняется высокая концентрация ионов кальция, поперечные мостики вновь образуются, АТФазная активность миозина возрастает и снова происходит гидролиз новых порций АТФ, дающий энергию для поворота поперечных мостиков с последующим их разрывом. Это ведет к дальнейшему движению толстых и тонких нитей навстречу друг другу и укорочению миофибрилл и мышечного волокна. В результате многократного образования, поворота и разрыва мостиков мышца может максимально сократиться, при этом тонкие нити наслаиваются друг на друга (иногда могут переплетаться), а толстые нити упираются в Z-пластинку (при сверхнапряжении их концы даже могут быть расплющены) (рис. 17).
Каждый цикл сокращения (образование, поворот и разрыв мостика) требует расходования одной молекулы АТФ в качестве источника энергии. Учитывая, что во всей мышце во время ее сокращения возникает огромнейшее количество поперечных мостиков, затраты АТФ на энергообеспечение мышечной деятельности очень велики. Расслабление мышцы (релаксация) происходит после прекращения поступления двигательного нервного импульса. При этом проницаемость стенки цистерн саркоплазматического ретикулума уменьшается, и ионы кальция под действием кальциевого насоса, использующего энергию АТФ, уходят в цистерны. Их концентрация в саркоплазме быстро снижается до исходного уровня. Снижение концентрации кальция в саркоплазме вызывает изменение конформации тропонина, что приводит к фиксации молекул тропомиозина в определенных участках актиновых нитей и делает невозможным образование поперечных мостиков между толстыми и тонкими нитями. За счет упругих сил, возникающих при мышечном сокращении в коллагеновых нитях, окружающих мышечное волокно, оно при расслаблении возвращается в исходное положение. Возвращению мышцы в исходное состояние также способствует сокращение мышц-антагонистов. Таким образом, процесс мышечного расслабления, или релаксация, так же как и процесс мышечного сокращения, осуществляется с использованием энергии гидролиза АТФ. Гладкие мышечные волокна по строению существенно отличаются от поперечно-полосатых. В гладких мышечных клетках нет миофибрилл. Тонкие нити присоединяются к сарколемме, толстые находятся внутри волокон (рис. 18).
В гладких мышечных волокнах отсутствуют также цистерны с ионами кальция. Под действием нервного импульса ионы Са2+ поступают в саркоплазму из внеклеточного вещества. Поступают ионы кальция в саркоплазму медленно и также медленно уходят из волокна после прекращения поступления нервного импульса. Поэтому гладкие мышцы медленно сокращаются и медленно расслабляются.
Поиск по сайту: |
 Рис. 9. Электронная микрофотография продольного среза участка мышечного волокна (увеличение в 10 ООО раз) (Л. Страйер, 1985)
Рис. 9. Электронная микрофотография продольного среза участка мышечного волокна (увеличение в 10 ООО раз) (Л. Страйер, 1985)
 Рис. 11. Схема строения молекулы миозина
Рис. 11. Схема строения молекулы миозина
 Рис. 12. Схема строения толстой нити (А. Уайт и др., 1981)
Рис. 12. Схема строения толстой нити (А. Уайт и др., 1981)
 Рис. 13. Схема строения двойной спирали из фибриллярного актина
Рис. 13. Схема строения двойной спирали из фибриллярного актина
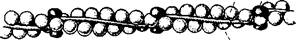 тропомиозин
Рис. 14. Схема строения тонкой нити (А. Уайт и др., 1981)
тропомиозин
Рис. 14. Схема строения тонкой нити (А. Уайт и др., 1981)
 Рис. 15. Электронная микрофотография продольного среза участка миофибриллы (увеличение - 300 000 раз) (Л. Страйер, 1985)
Рис. 15. Электронная микрофотография продольного среза участка миофибриллы (увеличение - 300 000 раз) (Л. Страйер, 1985)
 Рис. 17. Схема строения участка максимально укороченной миофибриллы
Рис. 17. Схема строения участка максимально укороченной миофибриллы
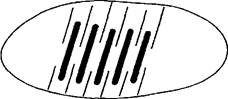 Рис. 18. Схема расположения толстых и тонких нитей в гладких мышечных волокнах
Рис. 18. Схема расположения толстых и тонких нитей в гладких мышечных волокнах