 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Оксиды и соли p-элементов
Как следствие особой устойчивости алюминия в ст.ок. +3, во-первых, он образует сложные вещества практически всегда только в этой ст.ок., например, Al2O3; а во-вторых, соединения Al(III) обладают крайне слабые окислительными свойствами. Так, Al2O3 проявляет их лишь под действием электротока. В отличие от Al, олово способно давать два оксида (SnO и SnO2), а свинец – четыре: желтый PbO, коричневый PbO2, оранжевый Pb2O3 и т.н. сурик Pb3O4 (красного цвета), последние два по сути являются солями. Благодаря яркой окрашенности оксиды Pb используют для приготовления красок. Раньше основой красок были свинцовые белила (PbOH)2CO3. Поэтому старинные картины со временем темнеют под действием сероводорода (являющегося примесью в воздухе) из-за перехода белил в черное вещество PbS. Однако, обрабатывая сульфид свинца раствором пероксида водорода, его можно окислить до PbSO4 белого цвета. Такую обработку проводят для осветления старинных картин и икон при их реставрации, после чего они становятся как новые. Благодаря неустойчивости свинца в ст.ок. +4 (вследствие f-сжатия) Pb3O4 и PbO2 применяются в качестве очень сильных окислителей: сурик – в производстве спичек (входит в состав и головки, и намазки), а PbO2 – в свинцовых аккумуляторах. В этих аккумуляторах чередуются пластины из свинца и из диоксида свинца, причем они погружены в 40%-ую серную кислоту. Если соединить пластины между собой проводником, то по нему пойдет электроток. Ток возникает как результат того, что PbO2 «отнимает» (через проводник) электроны у Pb, т.е. на пластинах осуществляются реакции:
При зарядке аккумулятора (от внешнего источника тока, чаще от электросети) идут обратные процессы, и восстанавливается способность аккумулятора давать ток. Как уже говорилось выше, если свинец стремится перейти из ст.ок. +4 в +2, то Sn наоборот. Поэтому соединения олова (II) являются сильными восстановителями. И в этом качестве они широко используются на практике. В частности, для выделения золота и серебра из растворов, например:
В щелочной среде восстанавливаются и более активные М, такие, как висмут:
Данная реакция сопровождается внешним эффектом – выпадением черного порошка металла Bi, поэтому она может служить качественной реакциейи на олово (II), и на висмут (III). Из соединений Sn(IV) применяют на практике кристаллический сульфид SnS2. Его блестящие золотистые чешуйки выглядят внешне как золото и химически почти также устойчивы (не растворяются даже в азотной кислоте). Поэтому используются для позолоты дерева и других материалов (под названием «сусальное золото»). Из алюминийсодержащих веществ издревле применяются (в медицине и при крашении тканей) квасцы или по-латински «алюмен» (отсюда название Al). Их общая формула MAl(SO4)2.12H2O, где М – однозарядные катионы ЩМ. Из-за гидролиза по Al3+ растворы этих соединений имеют кислую среду (отсюда их название «квасцы», что означает «кислые»). В твердом виде квасцы представляют собой прозрачные октаэдрические кристаллы. Если их осаждать, например, на шерстяную нитку при медленном испарении насыщенного раствора, то кристаллы получаются крупными и настолько красивыми, что могут служить елочными украшениями. Производство алюминия Если олово и свинец – это металлы, известные человечеству еще в древности (наряду с Ag, Au, Cu, Hg и Fe), то металлический алюминий получен только в 19 веке. Впервые его выделил в 1825 году Эрнстед. Пропустив хлор через раскаленную смесь глинозема и угля, он синтезировал хлорид алюминия, из которого восстановил Al амальгамой калия; а затем полученную амальгаму алюминия разложил, отогнав ртуть нагреванием. Этот способ был очень дорогим и вредным, да и продукт оказывался сильно загрязненным. Достаточно чистый и блестящий металл выделил Девиль в 1855 году, восстановив его натрием из смеси NaCl и хлорида алюминия, полученного сложным способом из глинозема. И этот метод был столь дорог, что Al ценился дороже золота. Перелом в истории производства алюминия наступил в 1886 году, когда стали применять электролиз расплава смеси Al2O3 с гексафтороалюминатом натрия (Na3 AlF6). Последний назвали криолитом (от греческого слова «криос» – холод), т.к. при добавлении его к глинозему (в соотношении 12:1) температура плавления снижается с 2050°С до 960°С. Это резко удешевило синтез алюминия и открыло ему дорогу в технику. И сейчас он один из наиболее используемых металлов. Аналогично Al получают и на современных предприятиях, но для повышения электропроводности расплава смеси глинозема и криолита добавляют еще CaF2 и другие соли. Суть электролиза условно можно представить следующими процессами: – диссоциация в расплаве:
– окисление кислорода аниона на угольном аноде:
– восстановление алюминия на катоде (дно электролитической ванны):
При этом затраты на 1 т Al: 2 т Al2O3, 40-60 кг криолита, 20-30 кг фторида кальция, 600 кг угля (чтобы наращивать анод, который выгорает под действием выделяющегося на нем кислорода) и 18 тыс. кВт-часов электроэнергии, т.е. производство достаточно дорогое. А выпускают ежегодно более десяти млн. тонн алюминия. Поэтому очень актуально использование вторсырья, что снижает затраты в 10 раз. Особо подчеркнем, что получение Al из вторсырья экологически безопасно, в то время, как выделение его из бокситов связано с выбросами в атмосферу многих очень вредных веществ: HF, токсичного органического вещества бенз(а)пирена и др., которые необходимо улавливать. Например, HF можно связать, пропуская отходящие газы через щелочной раствор. Отметим, что описанным выше способом получается т.н. технический алюминий, который содержит 0,3% примесей. А в сверхчистом Al, синтезированном с помощью дополнительных операций, примеси составляют лишь 10-4%. И такой алюминий не тускнеет со временем (ибо оксидная пленка, образующаяся на нем, очень тонкая, но в то же время плотная и равномерная). Он идет, в частности, на изготовление зубных коронок, т.к. пластичен, а после добавления микроколичеств стронция становиться сверхтвердым материалом, при обработке которого «летят» токарные резцы. Углерод и кремний
Поиск по сайту: |
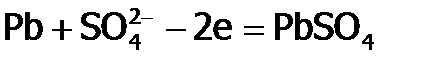 ,
,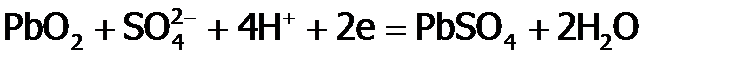 .
.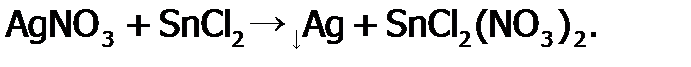
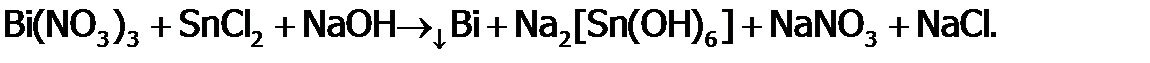
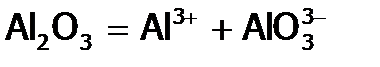 ,
,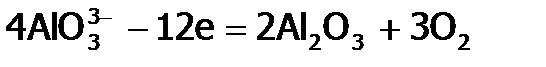 ,
,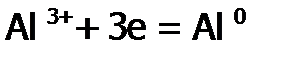 .
.