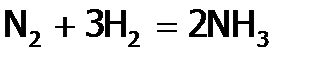|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Структура и физические свойства
Азот (в отличие от кислорода) не имеет аллотропных форм, ибо слишком прочна тройная связь в N2. Из-за жесткости этой связи частицы N2 слабо поляризуются. Как следствие: – незначительна растворимость азота (как и Н2) и в неполярных жидкостях, и в воде (около 15 мл N2 в 1 л Н2О при об.у., что в 2 раза меньше чем в случае О2); – очень низки его т.пл. (–2100С) и т.кип. (–1960С), поэтому N2 широко используется в качестве эффективного и дешевого охладителя; – азот не имеет цвета, запаха, вкуса, и в других отношениях биологически достаточно пассивен. Это отражено и в его названии, которое несет смысл: «не поддерживающий жизни»[2]. (Ибо при исследовании свойств азота выяснилось, что в его атмосфере животные быстро погибают.) В отличие от азота, фосфор, каждый атом которого образует по три
Белый фосфор (желтоватое, мягкое, как воск вещество) получается при конденсации паров, образующихся по реакции, и состоит из тетраэдров Р4 (рис. 5а). Это самые простые молекулы, которые могут сформироваться при трех  -связях у каждого атома. -связях у каждого атома.
Однако в тетраэдрах p-орбитали расположены друг к другу под углом 600, что значительно отличается от естественного угла между ними (900). Поэтому связи напряжены и со временем одна из них в каждой молекуле разрывается. Благодаря появляющимся при этом неспаренным электронам (на p-орбиталях) тетраэдры связываются друг с другом. (Теперь они уже искажены, ибо в них углы между p-орбиталями гораздо ближе к 900, а значит, состояние фосфора становится более устойчивым.) Так получаются цепи Рn (из искаженных тетраэдров – см. рис. 3б), т.е. формируется волокнистая структура – это красный фосфор (порошок фиолетово-кирпичного цвета). По описанному механизму Р4 при хранении без доступа воздуха при об.у. медленно переходит в Рn, быстрее при нагревании (но не выше 2400С). Обратный переход (красного фосфора в белый) осуществляется выше 2400С, но тоже в отсутствии О2. Частицы Рn значительно превосходят молекулы Р4 по числу атомов, и как следствие по величине Мr. Потому и свойства этих аллотропных форм резко различаются. Так, белый фосфор (в отличие от красного) летуч, имеет запах (чесночный), растворим в неполярных жидкостях. Его т.пл. (44,80С) намного ниже, чем у красного (6000С). И если Рn биологически достаточно пассивен, то Р4 – ядовит, а также вызывает долго не заживающие ожоги при попадании на кожу. Химические свойства Азот при об.у. очень инертен. Невозможно сжечь его даже в чистом кислороде. А если в сосуд с N2 внести горящие серу, фосфор, уголь или направить струю подожженного водорода, то они сразу же гаснут. Пассивность азота (и биологическая, и химическая) объясняется высоким значением Еа.с. для процессов, идущих с участием N2. Причины: очень прочная тройная связь в молекуле азота и симметричность данной частицы (а значит, нулевые эффективные заряды на ее атомах). Однако, если N2 активировать (разрядом, нагреванием или с помощью катализатора), то он окисляет даже пассивные М, такие как ртуть; а также неметаллы: фосфор (продукт P3N5), водород (NH3, точнее H3N) кремний (Si3N4), бор (BN) и др., то есть является достаточно активным. Фосфорс позиции термодинамики как окислитель слабее азота (из-за большего атомного радиуса Р и, значит, меньшей ЭО): реагирует лишь с металлами, образуя фосфиды (например, Na3P, Ca3P2, FeP и др.). Зато как восстановитель Pn (особенно P4) намного сильнее, чем N2,– фосфор окисляется даже серой (продукт – P2S5). И с точки зрениякинетики Pn (тем более P4) гораздо активнее, чем N2, т.к. в любой аллотропной форме Р нет тройных связей, как в молекуле азота, а лишь одинарные. И следовательно, величина Еа.с. для реакций с фосфором гораздо ниже, чем с N2 и требует, в частности, меньшего нагревания. Например, в кислороде воздуха P4 самовозгорается уже при температуре 500С, Pn – при 2500С (продукт одинаков – Р2О5), а N2 окисляется (до NO) лишь выше 30000С, причем только частично. (Отметим, что белый фосфор взаимодействует с О2 воздуха даже при об.у. (но медленно) с выделением световой энергии (свечение Р4 хорошо видно в темноте); отсюда название «фосфор», что по-гречески означает «светоносный».) Благодаря высокой восстановительной активности, Р используется в производстве спичек. Раньше в спичечные головки включали белый фосфор, и они часто самовозгорались. Теперь применяют только красный, причем он входит в состав намазки на коробке, а спичечные головки содержат серу и бертоллетову соль. При трении спички о коробку Pn переходит в Р4, который легко воспламеняется под действием KCIО3 (продукты: Р2О5 и KCI) и поджигает S, а сера – древесину спички. Мышьяк, сурьма и висмут (в силу их достаточной металличности), идут на приготовление сплавов с другими М; As используется также в полупроводниковой технике, а его соединения – в медицине. Установлено, что микроколичества мышьяка жизненно необходимы (в частности, его недостаток в организме приводит к анемии крови), но в больших дозах – это яд. Название «мышьяк» – это видоизмененное «мышиный яд» (ибо соединением As2O3, т.н. «белым мышьяком» обычно травили мышей). Азот, благодаря своей кинетической пассивности используют часто как инертную среду (например, для проведения реакций, исключающих присутствие активных веществ воздуха: кислорода или углекислого газа), но главное: N2 является сырьем при синтезе аммиака. Аммиак и соли аммония Получение аммиака
идет с выделением тепла (46,2 кДж/моль). Следовательно, как и при окислении SO2 до SO3, увеличение температуры должно снижать выход продукта, но в промышленности вынуждены повышать Т до 4000C (несмотря на присутствие катализатора), чтобы скорость процесса была достаточно высокой. Кроме того, для большего выхода NH3 увеличивают давление до 200-1000 атмосфер, поскольку реакция идет с уменьшением объема. Но даже в этих жестких условиях выход аммиака не более 30%. Правда, его легко отделить от непрореагировавших исходных веществ (азота и водорода), т.к. NH3 имеет сравнительно высокую т.кип. (–33,4°С) благодаря действию между его молекулами Н-связей. А под большим давлением, которое создается в системе при синтезе аммиака, он сжижается даже при комнатной температуре. (Остающиеся при этом газы N2 и H2 возвращаются обратно в колонну синтеза NH3.) До сих пор ведутся работы по улучшению катализатора (например, добавлением к нему т.н. активаторов), чтобы снизить температуру процесса и т.о. повысить выход аммиака. Его мировое производство составляет несколько десятков миллионов тонн в год. Поэтому даже небольшое увеличение выхода NH3 оборачивается большим сокращением затрат на его получение. Испытаны уже тысячи веществ, но пока катализаторы, созданные человеком, далеки по эффективности от биологического, который работает в азобактериях и связывает азот воздуха при обычных условиях. Подчеркнем, что в отличие от аммиака, соединения фосфора с водородом, из-за большего радиуса атома и невысокой электроотрицательности P (равной 2,1, а у N – 3) значительно менее устойчивы и самовоспламеняются на воздухе.
Поиск по сайту: |