 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Кислородосодержащие соединения фосфора
В отличие от N (оксиды которого термодинамически нестабильны к распаду на азот и кислород) фосфор образует с О очень прочные связи, т.е. его оксиды устойчивы к отщеплению кислорода. Оксиды фосфора P2O3 и P2O5 синтезируют, сжигая Р при недостатке и избытке О2 соответственно. С водой они дают кислоты: фосфористую H3PO3 и фосфорную H3PO4. (Причем H3PO4 получается через образование вначале метафосфорной кислоты HPO3.) Все рассмотренные выше фосфорсодержащие вещества – твердые, в отличие от большинства аналогичных соединений азота. Вследствиеневысокой ЭО фосфора его гидроксиды слабы и как кислоты (даже HPO3), и как окислители (с металлами реагируют лишь за счет H+, ибо Р очень устойчив в положительных ст.ок., особенно в высшей. Поскольку фосфорная кислота трехосновна, то могут быть получены и дигидрофосфаты (в частности, NaH2PO4), и гидрофосфаты (Na2HPO4), и средние соли (Na3PO4). Из средних растворимы в воде только фосфаты ЩМ, а остальные – лишь в кислотах (как результат образования слабодиссоциирующих гидро- и дигидрофосфат-ионов). Поэтому именно в нейтральной (а не в кислой!) среде нужно проводить качественную реакцию на Минеральные удобрения Природные фосфаты кальция при обработке кислотами, в частности, серной, в зависимости от количества кислоты дают или среднерастворимый продукт CaHPO4 (преципитат), или Ca(H2PO4)2 (суперфосфат), или H3PO4. (Последние два вещества хорошо растворяются в воде.) Если на фосфат кальция действовать фосфорной кислотой, то получается т.н. двойной суперфосфат, т.е. без балласта CaSO4 (который образуется при использовании H2SO4). Все указанные фосфаты кальция (и кислые, и даже средний Сa3(PO4)2) являются фосфорными удобрениями. Но важно химически грамотно выбирать, какой из них вносить в данную почву. Например, средний фосфат лучше применять для кислых земель[5], т.к. в них он, взаимодействуя с органическими кислотами, переходит в растворимую форму (и т.о. приобретает способность всасываться корнями растений). При этом одновременно снижается кислотность почвы, благодаря чему улучшается ее качество. (В частности, повышается проницаемость для воды и воздуха, что способствует лучшей жизнедеятельности полезных микробов.) Очевидно, кислые фосфаты кальция можно вносить лишь в достаточно щелочныеземли (рН = 7 – 8). Кроме фосфорных удобрений используют тоже очень нужные растениям азотные (нитраты, соли аммония) и калийные (соли калия), а также двойные удобрения (содержащие и Р, и N): Без вмешательства человека почвенные запасы азота, фосфора, калия (а также кальция и др.) восстанавливаются естественным путем при разложении останков растений и животных. В частности, азот- и фосфорсодержащие органические вещества перерабатываются микробами в неорганические соединения, которые усваиваются растениями. (Так осуществляется естественный оборот Р в природе.) Но если урожай уносится с полей, то необходимо вносить в землю не только макроудобрения (указанные выше), но и микро-, т.н. витамины полей. Это соединения бора, меди, кобальта, марганца, цинка, молибдена и иода. Они требуются в очень небольших количествах, а превышение нормы вредит растениям. Передозировка опасна и в случае макроудобрений, т.к. их избыток из почвы вымывается в водоемы и способствует разрастанию водорослей, поглощающих растворенный в воде кислород, поэтому гибнут рыбы и др. К тому же, анаэробное (т.е. без доступа O2) разложение останков организмов приводит к образованию веществ, которые превращают водоемы в болота. Особенно опасна передозировка нитратов, т.к. с растениями, поглотившими их, нитраты попадают в живые организмы, где превращаются в нитриты. Последние делают гемоглобин неспособным переносить кислород (поэтому возможна даже смерть), а также провоцируют раковые заболевания. Помимо использования в качестве сельскохозяйственных удобрений фосфаты идут также на приготовление моющих средств и как добавки в корм животным. В последнем случае для синтеза фосфата кальция применяют кислоту Н3РО4, полученную сжиганием чистого фосфора (с последующей гидратацией Р2О5), поскольку природные минералы содержат вредные для скота примеси, например фторид-ионы.
13. Гидролиз соли – это обменное взаимодействие ионов соли с молекулами воды, в результате которого, как правило, происходит изменение
CO32− + H2O = HCO3− + OH− Na2CO3 + Н2О = NaHCO3 + NaOH (раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu2+ + Н2О = CuOH+ + Н+ CuCl2 + Н2О = CuOHCl + HCl (раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени) 3. Гидролиз соли слабой кислоты и слабого основания:
2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(осадок) + ЗН2S(газ) Al2S3 + 6H2O = 2Al(OH)3 + 3H2S (равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
Количественно процесс гидролиза, а также каждую его ступень характеризуют степенью гидролиза (
запишется следующим образом: Считая Итак: Величина константы гидролиза определяется отношением ионного произведения воды к константам диссоциации продуктов гидролиза, являющихся слабыми электролитами: Для солей 2 и 3 типа зависимость следующая:
Например, для гидролиза хлорида алюминия по 1-ой ступени:
Поиск по сайту: |
 . (Например, с раствором AgNO3, дающим с фосфат-анионами желтый осадок Ag3PO4.)
. (Например, с раствором AgNO3, дающим с фосфат-анионами желтый осадок Ag3PO4.) и
и  ,. Причем в кислые почвы вносят не гидролизующиеся (по катиону) соли KCl, KNO3, NaNO3 или аммиачную воду. А некислые земли можно удобрять, например, нитратом аммония NH4NO3, который гидролизуясь понижает рН природной воды.
,. Причем в кислые почвы вносят не гидролизующиеся (по катиону) соли KCl, KNO3, NaNO3 или аммиачную воду. А некислые земли можно удобрять, например, нитратом аммония NH4NO3, который гидролизуясь понижает рН природной воды. раствора. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
раствора. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону): ) и константой равновесия. Величина
) и константой равновесия. Величина  показывает долю гидролизованных частиц данного сорта (в результате данной ступени процесса) и зависит, в частности, от концентрации исходной соли, в отличие от термодинамической константы равновесия (
показывает долю гидролизованных частиц данного сорта (в результате данной ступени процесса) и зависит, в частности, от концентрации исходной соли, в отличие от термодинамической константы равновесия (  ). Выражение последней, например, для первой ступени гидролиза соли 2-го типа:
). Выражение последней, например, для первой ступени гидролиза соли 2-го типа:
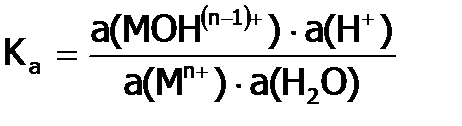 .
. постоянной, получим, что и произведение
постоянной, получим, что и произведение  тоже постоянная величина; она называется константой гидролиза и обозначается
тоже постоянная величина; она называется константой гидролиза и обозначается  .
. .
. (для солей 4 типа).
(для солей 4 типа). или
или 
 значение
значение  рассчитывается по формуле:
рассчитывается по формуле: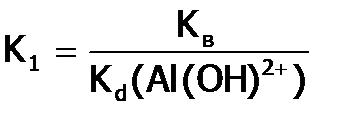 , т.е.
, т.е.  .
.