 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Структура и физические свойства простых веществ
Особенности углерода. Все простые вещества С образованы атомами углерода в возбужденном состоянии sp3, , а поскольку при этом еще и атомный радиус С достаточно мал, то Кроме того, атомы углерода менее склонны, чем N, давать Однако, атомы С могут формировать между собой и достаточно эффективные Карбин. Данное простое вещество углерода имеет, как и пластическая сера, волокнистую структуру, но его волокна не зигзагообразные, а линейные. Они имеютодинаковую форму – промежуточную между шаром и гантелью. (На рисунках 6«а» и 7 одна из ГО для наглядности нарисована более жирной линией.) Такой процесс смешивания s-орбитали и одной p-орбитали называется sp-гибридизацией.
Поскольку ГО имеют асимметричную форму, то они в большей степени перекрываются с орбиталями других атомов (при формировании Подчеркнем, что угол между осями двух
 - -  связи с тремя соседними С, используя s-, px- и pz-орбитали (рис. 6«б»). А значит, имеем sp2-гибридизацию, при которой углы между осями связей равны по 120°. Таким образом фрагмент из 4-х атомов представляет собой плоский треугольник (см. рисунок 8 – обведенное пунктиром). Треугольные фрагменты, объединяясь между собой, дают плоский слой, составленный из шестиугольников (рисунок 8), в которых углы как раз по 120°. связи с тремя соседними С, используя s-, px- и pz-орбитали (рис. 6«б»). А значит, имеем sp2-гибридизацию, при которой углы между осями связей равны по 120°. Таким образом фрагмент из 4-х атомов представляет собой плоский треугольник (см. рисунок 8 – обведенное пунктиром). Треугольные фрагменты, объединяясь между собой, дают плоский слой, составленный из шестиугольников (рисунок 8), в которых углы как раз по 120°.
Итак, решетка графита построена из слоев. Они связаны между собой с помощью ММС. А четвертая орбиталь (py-) каждого атома С графита участвует в общем В целом решетка графита прочная, благодаря чему он термостоек (т.пл. 3800°С), поэтому из него делают огнеупорные изделия, например, тигли. Но поскольку ММС между слоями значительно слабее, чем ХС в слое, то возможно довольно легкое отслаивание графита. В частности, при надавливании им на бумагу, на ней остается его серый след. Поэтому графит (его название в переводе с немецкого означает «пишущий») используют для изготовления карандашей, а также в технике в качестве твердой смазки между трущимися деталями. Отметим, что многие простые соединения С (кокс, сажа, основное вещество угля и т.п.) являются мелкокристаллическими разновидностями графита. Сравнительно недавно получены новые простые вещества C: трубчатый углерод (его молекулы имеют вид трубок), фуллерены (состоящие, например, из «шаров» С60 или С70) и др. И все они построены, как и графит, из треугольников, но не плоских, ибо в них атомы С имеют лишь приблизительно sp2-гибридизацию орбиталей. Алмаз. Самая прекрасная форма углерода – алмаз (прозрачное вещество, сильно преломляющее световые лучи). В нем все 4 орбитали С (s- и три p-) каждого атома углерода участвуют в Как результат того, что каждый атом С в алмазе (кроме поверхностных) имеет по четыре Благодаря столь высокой твердости, применение алмазов в промышленности в 2-3 раза увеличивает мощность оборудования, а также срок его службы. Используют алмазы для резки стекла, шлифования твердых материалов, бурения горных пород и др. Причем почти половина применяемых образцов получены искусственно из графита. Один из способов синтеза алмаза – действие на сильно нагретый графитсверхвысокого давления, которое сближает слои графита настолько, что между ними формируются При этом sp2-гибридизация переходит в sp3-, а значит, слоистая решетка сменяется координационной (как следствие, исчезают проводимость и «пачкающие» свойства), т.е. образуется алмаз. По твердости он как настоящий, но внешне не привлекателен (из-за примеси графита). Так что для украшений годятся лишь природные алмазы. Самый крупный из них весит 600 г. Концентрированные серная и азотная кислоты при нагревании окисляют углерод до углекислого газа: C + 2 H2SO4 (t )® CO2 + 2 SO2 + H2O, C + 4HNO3 (t )® 3CO2 + 4NO2 + 2H2O. к кислотам кремний более устойчив: на него действует только смесь концентрированных HNO3 и HF:
Эти кислоты как бы объединяют свои «усилия»: HNO3 окисляет Si до Si4+, точнее до SiO2, а HF растворяет SiO2, образуя фторокремниевую кислоту H2SiF6. И только при таком двойном действии кислот кремний реагирует с ними. Поэтому добавки его к металлам (в частности, к железу) повышают их кислотостойкость. КОНСТАНТА РАВНОВЕСИЯ Большинство процессов в ходе их осуществления замедляются, т.к. (в соответствии с кинетическими уравнениями) скорость прямой реакции снижается (в результате расхода реагентов), а обратной - растет (из-за накопления продуктов). И когда эти скорости становятся равными, имеем состояние химического равновесия. Оно является динамическим, поскольку скорости прямого и обратного процессовне нулевые. Из равенства скоростей
Отношение Подчеркнем, что Из формулы видно, что если Качественно оценить соотношение реагентов и продуктов при наступлении равновесия помогает правило: равновесие обычно смещено в сторону или более слабых электролитов, или менее растворимых веществ, или более летучих. Отметим, что Напротив, величина СДВИГ РАВНОВЕСИЯ Если на равновесную систему оказывается внешнее воздействие (т.е. действием извне изменяется температура или давление, или концентрация какого-либо вещества), то это приводит к нарушению равновесия, т.е. к протеканию реакции в ту или иную сторону до установления нового равновесия. Установление нового равновесия под действием извне называется сдвигом химического равновесия. Направление сдвига можно определить, используя принцип Ле Шателье: при изменении параметров системы воздействием извне равновесие смещается в сторону процесса, который ослабляетэто воздействие. Рассмотрим, как данный принцип объясняется с позиции кинетики или термодинамики: а) Влияние концентраций. Если мы повысим концентрацию какого-либо реагента (например, внесением дополнительного количества соответствующего вещества в систему), то тем самым увеличим Например, при введении в систему (4) реагентов B или C равновесие сдвигается в сторону образования продуктов D и Е. При увеличении же концентрации D или E наблюдается обратное смещение. Таким образом, при указанных сдвигах снижается концентрация внесенного нами вещества, т.е. система ослабляет внешнее воздействие(а значит, выполняетсяпринцип Ле Шателье). б) Влияние давления[15]. Это влияние на состояние равновесия стоит учитывать лишь, если в результате реакции изменяется суммарное количество газообразных веществ. Например, оно растет при разложении аммиака на простые вещества:
При повышении давления в данной системе в) Влияние температуры. Для обратимых процессов, если прямая реакция идет с экзоэффектом, то обратная – с эндоэффектом, но с ростом S ( Поскольку значения Очевидно, при охлаждении системы (внешним воздействием) наблюдается обратный сдвиг, т.е. в сторону экзопроцесса, и выделяемое тепло отчасти компенсирует снижение температуры, вызванное действием извне. Так объясняется действие принципа Ле Шателье при варьировании температуры. Отметим, что Т, влияя на положение равновесия, изменяет (в отличие от С и р) и значение Подчеркнем, что введение катализатора в систему (в отличие от изменения Т) не влияет на величину Ка (не смещает равновесие), ибо в одинаковой степени увеличивает скорости и прямой, и обратной реакций, ибо и та, и другая идут через образование одного и того же а.к. 18. D-металлы .Св-ва. Большое число степеней окисления. Образование комплексных соединений. Образование окрашенных соединений. Парамагнетизм. Способность катализировать реакции. Все d – элементы являются металлами. Как правило, они отличаются высокой твердостью, тугоплавкостью, значительной электропроводностью. Для каждой декады d – элементов наиболее устойчивы конфигурации d 0 (Sc, Y, La), d 5 (Mn, Tc, Re), d 10 (Zn, Cd, Hg). Примеры: Ti 4 + (d 0), Fe 3 + (d 5), Zn 2 + (d 10) - устойчивы; Cr 2 + (d 4), Mn 3 + (d 4) – нестабильны. особенности d – элементов: большой выбор их валентных состояний и, как правило, широкие пределы изменения окислительно-восстановительных и кислотно-основных свойств. Полярность связей в соединениях с ростом степени окисления уменьшается. Для степени окисления (1 и 2) связь близка к ионной, для максимальной степени окисления она приближается к ковалентной. Поэтому, например, низшие оксиды и гидроксиды являются основными, высшие – кислотными, многие низшие галогениды – ионные кристаллы (хорошо растворимые соли), высшие галогениды – легкоплавкие, легколетучие вещества, подвергающиеся гидролизу. Хим. Св-ва (на примере Mn): Mn + 2 HCl = Mn Cl 2 + H 2 (j 0 (Mn 2 + / Mn) = - 1, 19 B). Mn + 8 HNO 3 = 3 Mn (NO 3 ) 2 + 2 NO 2 + 4 H 2 O, Mn + 2 H 2 SO 4 (конц.) = MnSO 4 + SO 2 + 2 H 2 O. Mn + 2 H2O = Mn(OH) 2 ¯ + H 2 (при нагревании), Переходные металлы содержатся в организмах в очень малых количествах, и уже из этого можно сделать осторожный вывод, что их значение (доказанное прямым опытом) должно быть связано с катализом. Ведь именно активные катализаторы могут способствовать быстрым изменениям состава вещества действуя в малых концентрациях. В дальнейшем мы увидим, что такое предположение в большинстве случаев оказывается верным. Но переходные металлы могут еще выполнять (вместе с органическими соединениями) и другую функцию - переносить с места на место группу атомов или целые молекулы, закреплять молекулы в определенном положении, поворачивать их, поляризовать их и т.п
Поиск по сайту: |
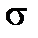 -связь С–С оказывается максимально прочной .
-связь С–С оказывается максимально прочной . -перекрывания (из-за большего радиуса С). Поэтому частицы С2, хотя и существуют но, в отличие от N2, не стабильны. Напротив, гораздо более устойчивы гомоядерные полимеры, в которых атомы углерода имеют по четыре
-перекрывания (из-за большего радиуса С). Поэтому частицы С2, хотя и существуют но, в отличие от N2, не стабильны. Напротив, гораздо более устойчивы гомоядерные полимеры, в которых атомы углерода имеют по четыре  -перекрывании, давая двойные (или тройные) связи в цепи:
-перекрывании, давая двойные (или тройные) связи в цепи: 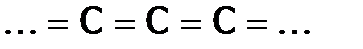 (
(  )
) -перекрывании со всеми атомами своего слоя. Это общее
-перекрывании со всеми атомами своего слоя. Это общее  -перекрывание обеспечивает pу-электронам почти такую же подвижность, как в металлах. Вследствие чего графит имеет серый, как многие М, цвет и проводит ток (но только вдоль слоев, а не перпендикулярно к ним).
-перекрывание обеспечивает pу-электронам почти такую же подвижность, как в металлах. Вследствие чего графит имеет серый, как многие М, цвет и проводит ток (но только вдоль слоев, а не перпендикулярно к ним). , а 5 атомов углерода, связанных указанным образом, образуют тетраэдр, т.е. объемную форму.
, а 5 атомов углерода, связанных указанным образом, образуют тетраэдр, т.е. объемную форму. .
. для реакции (4) следует, что
для реакции (4) следует, что или
или  .
. – это константа равновесия. А поскольку она выражена через активности (в относительных единицах, как и в кинетических уравнениях), то обозначается
– это константа равновесия. А поскольку она выражена через активности (в относительных единицах, как и в кинетических уравнениях), то обозначается  . Таким образом:
. Таким образом:  , а значит,
, а значит,  .
. ) в соответствии с формулой:
) в соответствии с формулой:  . То есть величина
. То есть величина  ) и от Т.
) и от Т. , то
, то  (т.е.
(т.е.  ). А значит, при наступлении равновесия в системе, в основном, присутствуют продукты реакции (см. выражение
). А значит, при наступлении равновесия в системе, в основном, присутствуют продукты реакции (см. выражение  (рассчитанная по формуле (3)) и
(рассчитанная по формуле (3)) и  (из равенства (3б)) – разные термодинамические величины. Так,
(из равенства (3б)) – разные термодинамические величины. Так, 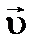 (см. кинетическое уравнение для прямого процесса). Как следствие, равновесие реакции сместится вправо.
(см. кинетическое уравнение для прямого процесса). Как следствие, равновесие реакции сместится вправо. .
.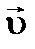 увеличивается в меньшей степени, чем
увеличивается в меньшей степени, чем 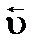 , т.к. общий порядок прямой реакции ниже, чем обратной, а повышение p в системе (например, из-за уменьшения ее V) вызывает практически одинаковый рост активностей всех газов. Как результат, равновесие сдвинется влево. Благодаря чему суммарное количество газообразных веществ уменьшится, и, как следствие, давление данной системы несколько снизится по сравнению с p, созданным внешним воздействием – в соответствии с принципом Ле Шателье.
, т.к. общий порядок прямой реакции ниже, чем обратной, а повышение p в системе (например, из-за уменьшения ее V) вызывает практически одинаковый рост активностей всех газов. Как результат, равновесие сдвинется влево. Благодаря чему суммарное количество газообразных веществ уменьшится, и, как следствие, давление данной системы несколько снизится по сравнению с p, созданным внешним воздействием – в соответствии с принципом Ле Шателье. ).
). и
и  реакции мало зависят от Т (раздел 2.1.2), а температура входит лишь во второе слагаемое формулы (3), то с повышением T растет лишь Т
реакции мало зависят от Т (раздел 2.1.2), а температура входит лишь во второе слагаемое формулы (3), то с повышением T растет лишь Т  , а значит,
, а значит,  (см. формулу (3б)), а потому и величину
(см. формулу (3б)), а потому и величину 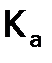 .
.