 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Опыт 4. Влияние катализатора на скорость химической реакции. Каталитическое восстановление роданида железа (3).
В двух пробирках получить роданид железа (3). Для этого в каждую из пробирок налить по 10 капель раствора роданида калия и по 1 капле хлорида железа (3). В одну из пробирок внести 1 каплю раствора сульфата меди. Затем в обе пробирки одновременно добавить по 10 капель тиосульфата натрия (предварительно приготовленного в двух других пробирках). Наблюдать различную скорость обесцвечивания раствора. Задания: 1. Составить уравнение обменной реакции между роданидом калия и хлоридом железа (3) ___________________________________________________________________________ 2.Записать уравнение реакции восстановления роданида железа (3) тиосульфатом натрия. ___________________________________________________________________________ ___________________________________________________________________________ 3. Сделать вывод о влиянии катализатора на скорость реакции. Вывод________________________________________________________________________________________________________________________________________________
Вопросы к защите работы. 1. Что называется скоростью химической реакции и как она зависит от концентрации реагирующих веществ? 2. Как зависит скорость реакции от температуры? 3. Что называется катализатором и катализом? 4. Что такое ингибиторы, антиоксиданты, синергисты? 5. Определить, как изменится скорость прямой реакции, протекающей в растворе 2NaN3 + I2 = 2NaI + 3N2, если концентрацию NaN3 увеличить в 3 раза, а концентрацию I2 уменьшить в 3 раза. Напишите выражение для скорости обратной реакции. Лабораторная работа № 2. Тема: «Адсорбция уксусной кислоты на активированном угле». Цель работы: изучение адсорбции уксусной кислоты из водных растворов различных концентраций на активированном угле при постоянной температуре, построение изотермы адсорбции Г= f(С) и нахождение опытным путем констант в уравнениях, применяемых в системе «уксусная кислота - активированный уголь». Оборудование:конические колбы, пипетки, мерные цилиндры, титровальная установка, ступка с пестиком, фильтровальная бумага, воронки; Реактивы: 1н. раствор уксусной кислоты, 0,1н. раствор гидроксида натрия, фенолфталеин. Ход работы. 1. Готовят шесть растворов уксусной кислоты различных концентраций (концентрации указываются преподавателем) в интервале от 0,6 до 0,05 н. Все эти растворы готовят в объеме 50 мл разбавлением исходного, приблизительно 1,0н. раствора СН3СООН. Для приготовления растворов сначала рассчитывают необходимый объем уксусной кислоты по формуле С0V0 = CV где С0 и V0 – объем (мл) и концентрация (нормальность) исходного раствора СН3СООН; C и V – те же величины приготовленного раствора. Рассчитанный объем исходной кислоты отмеряют пипеткой в мерную колбу на 50 мл и добавляют необходимое количество воды до метки. Растворы переносят в сухие конические колбы (1-й ряд). 2. Для проведения адсорбции с помощью пипетки берут из приготовленных растворов по 25 мл и помещают их в сухие колбы (2-й ряд). В те же колбы (во все одновременно) вносят заранее приготовленные навески активированного угля по 0,5 г (навески угля (m) берут на технических весах). Колбы с раствором и углем выдерживают 40 минут постоянно встряхивая. 3.Определяют точную концентрацию исходных растворов уксусной кислоты (1-й ряд), титруя щелочью с фенолфталеином (нормальность щелочи известна). Для титрования берут по 5 мл приготовленных растворов. Концентрацию уксусной кислоты в растворе рассчитывают по формуле: С0к = где Ск и Vк концентрации (моль/л) и объем (мл) раствора уксусной; Сщ и Vщ те же величины для раствора щелочи, пошедшей на титрование. Данные заносят в таблицу 1. Таблица 1. Определение начальной концентрации уксусной кислоты
4.Через 40 минут растворы (2-й ряд) отфильтровывают от угля в заранее приготовленные сухие колбы (3- ряд). Все растворы фильтруют одновременно. В фильтратах определяют оставшуюся не адсорбированную уксусную кислоту титрованием щелочью с фенолфталеином, так же, как в п.3. Полученные данные заносят в таблицу 2.
Таблица 2. Определение конечной концентрации уксусной кислоты.
5.Из полученных данных рассчитывают количество адсорбированной уксусной кислоты, результаты заносят в таблицу 3. Таблица 3.
6.По результатам таблицы 3 строят графические зависимости.
Определяют постоянные α и Вопросы к защите работы. 1. Что такое адсорбция? 2. Какие факторы влияют на адсорбцию газов (жидкостей) твердыми адсорбентами? 3. Что такое изотерма адсорбции? 4. Какие уравнения описывают адсорбцию на твердой поверхности? 5. Что означают постоянные величины в уравнениях изотермы адсорбции? 6. Как экспериментально определяется адсорбция на твердом адсорбенте? 7. Как приготовить растворы точной концентрации? 8. Что такое титрование и какова его цель?
Поиск по сайту: |
 ,
, ,
В молях
,
В молях


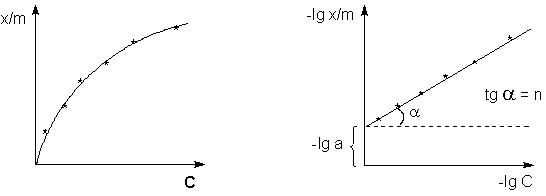
 уравнения Фрейндлиха.
уравнения Фрейндлиха.