|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Обнаружение пероксидов
Прежде чем приступить к перегонке эфира или другого способного окисляться растворителя, следует убедиться в отсутствии в нем пероксидных соединений. Проведение теста на наличие пероксидов обязательно перед использованием растворителя для экстракции или других целей, если в дальнейшем предполагается его упаривание, а также при работе с соединениями, способными вступать в реакции с участием радикалов. Рекомендуются следующие методы быстрого обнаружения пероксидов в жидкостях. 1. В 50 мл 18% НСI растворяют 9г FeSO4·7H2O, добавляют 100-200 мг Предел чувствительности метода- 0,001% пероксида. 2. В закрытой пробирке встряхивают в течение 1мин 10 мл эфира и 1мл свежеприготовленного 10% раствора KI. При рассматривании на фоне белого экрана этой смеси не должно быть заметного окрашивания. Появление желтого окрашиванияэфирного слоя указывает на наличие пероксидов. Предел чувствительности метода -0,005% пероксида. 3. В 1мл ледяной CH3COOH растворяют около 100 мл NaI или KI. К раствору добавляют 1 мл анализируемой жидкости. По интенсивности окраски от желтой до коричневой приблизительно оценивают количество пероксидов. В отсутствие пероксидов окраска не появляется. 4. В 100 мл дистиллированной воды растворяют 50 мг (TiSO4)2 и добавляют 1 мл концентрированной H2SO4. затем 5 мл анализируемой жидкости встряхивают с 2-3 мл приготовленного раствора. Появление желтой окраски указывает на присутствие пероксидов. 5. К 1 мл воды, содержащий 1мг Na2Cr2O7 и 1 каплю разбавленной H2SO4, добавляют 2-3 мл анализируемой жидкости. При наличии пероксидов органический слой приобретает голубую окраску (ион перхромата). Метод пригоден для определения пероксидов в жидкостях, нерастворимых в воде. Удаление пероксидов Обработка солями металлов.При перегонки сухого эфира, содержащегонекоторое количество пероксидов, в перегонную колбу добавляют либо хлорид меди Cu2CI2 или олова SnCI2 в количестве 5г на 1л эфира, либо гидрохинон в количестве 1г на 1л эфира. Экстракция концентрированным раствором щелочи.Этим методом могут быть экстрагированы пероксиды из эфиров, нерастворимых или малорастворимых в воде. Так, при перемешивании в течение 0,5ч 1об. ч. 23% NaOH с 10 об. ч. диэтилового эфира пероксиды полностью гидролизуются. Следует иметь в виду, что некоторые пероксиды, например дитрет-бутилпероксид, устойчивы к гидролизу. Обработка водными растворами неорганических восстановителей.Этот способ позволяет быстро удалить пероксиды из эфиров, не смешивающихся с водой. Наибольшее распространение получили растворы сульфата железа (II), метабисульфита натрия Na2S2O5, сульфида натрия. Сульфат железа (II) используют в виде 30%-го раствора в количестве 10-15 мл на 1л эфира. Пероксиды полностью удаляются при встряхивании эфира с раствором восстановителя в делительной воронке в течение 3-5 мин. Обработка ионообменной смолой.Это простой и надежный метод удаления пероксидов из эфиров и других растворителей высокой чистоты без перегонки и потери растворителя. Так, в эксперименте с помощью колонки диаметром 10 мм, содержащей 4 г анионообменной смолы Dowex-1, полностью удалили пероксид из 2-литровой бутыли с диэтиловым эфиром, предварительно содержавшимся при доступе воздуха в течение 3 месяцев. Адсорбция оксидом алюминия.Хорошим адсорбентом для удаления пероксидов из органических растворителей служит активированный оксид алюминия. Имеющийся в продаже оксид алюминия для хроматографии первой и второй степени активности пригоден для использования без дополнительного прокаливания. Если необходимо активировать оксид алюминия, его прокаливают в течение 6 ч при 300-400оС. Для удаления пероксидов растворитель выдерживают в течение суток над оксидом алюминия. Перемешивание смеси позволяет сократить время обработки до 1-1,5ч. Еще быстрее можно освободиться от пероксида, пропустив растворитель через стеклянную колонку, заполненную оксидом алюминия. Оксид алюминия не разрушается, а лишь адсорбирует пероксиды, поэтому сразу после обработки растворителя следует, не дожидаясь высыхания адсорбента, залить его 5% раствором FeSO4. Можно элюировать адсорбированный пероксид горячей водой или метанолом. После обработки следует убедиться в отсутствии пероксида в растворителе, повторив один из предложенных выше тестов. Метод пригоден для извлечения пероксидов из любых растворителей, в том числе смешивающихся с водой, например диоксана. Одновременно происходит осушка и очистка растворителей, особенно от примесей кислотного характера.
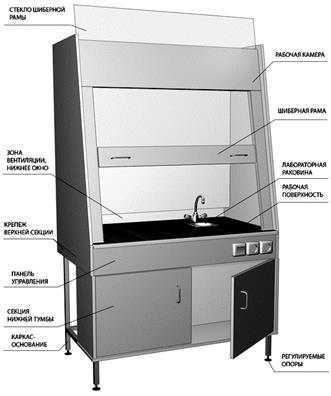
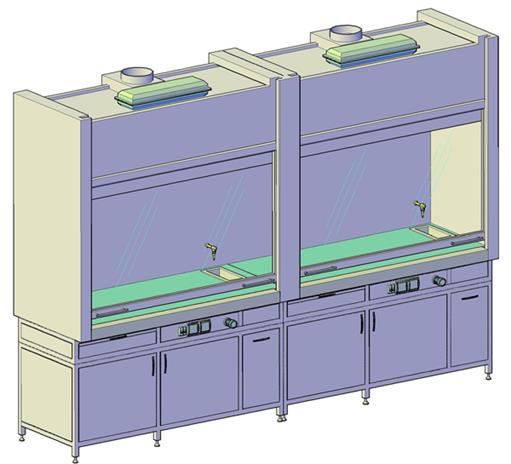
Вентиляция Вентиляция — эффективное средство, предотвращающее образование пожаро- и взрывоопасных концентраций горючих паров. Для защиты персонала от негативного воздействия токсических веществ в лаборатории органического синтеза используются ВЫТЯЖНЫЕ ШКАФЫ (рис 3, 4 ). Принцы работы вытяжных шкафов заключается в удалении паров вредных веществ из рабочей камеры через специальные вытяжные отверстия. Для усиления вентиляционных возможностей используются вентиляторы, которые обеспечивают принудительную вытяжку загрязненного воздуха. Современные вытяжные шкафы выполнены, как правило, в пожаро- и взрывобезопасном исполнении, они изготавливаются с использованием материалов, устойчивых к агрессивному воздействию химических веществ. Для удобства и комфортного использования вытяжные шкафы снабжаются электрическими розетками, выключателями и автоматами отключения. Имеются технологические отверстия, в которые устанавливаются водопроводные краны, раковина и краны для подачи газов. В нижней части вытяжных шкафов, как правило, имеются вентилируемые тумбы для безопасного хранения химических реактивов.
При отсутствии эффективной вентиляции пары низкокипящих органических растворителей способны опускаться вниз и «растекаться» по горизонтальным поверхностям, например, по поверхности рабочего стола. При этом взрывоопасные концентрации неожиданно для экспериментатора создаются сравнительно далеко — на расстоянии до 3—5 м от места работы с ЛВЖ. В наибольшей степени это свойство проявляется у паров диэтилового эфира и сероуглерода, что создает дополнительную опасность при работе с ними. Существует ошибочное мнение, будто свойство паров опускаться вниз определяется только молекулярной массой вещества. Однако пары ртути даже в неподвижном воздухе не опускаются вниз, а рассеиваются конвективными воздушными потоками. Следует иметь в виду, что в воздух попадает не изолированный пар вещества, а паровоздушная смесь. Способность ее опускаться вниз или рассеиваться определяется степенью утяжеления воздуха парами, которая в свою очередь представляет собой функцию давления насыщенного пара данного вещества при данной температуре и его молекулярной массы. В соответствии с эмпирическими данными, при степени утяжеления воздуха 25% и более паровоздушная смесь (при отсутствии принудительного перемешивания) опускается вниз. Таким свойством обладают пары растворителей, кипящих около 80 °С и ниже: бензола, четыреххлористого углерода, диэтилового эфира и др. 12. Техника безопасности при работе Щелочные металлы широко применяются в лабораториях в качестве реагентов для синтеза и анализа, активных восстановителей, а также осушителей для органических растворителей. Эти металлы относятся к наиболее активным элементам, что обуславливает их высокую пожаро- и взрывоопасность, а также агрессивность по отношению к тканям организма. Чрезвычайно опасны ожоги расплавленными щелочными металлами. Термические ожоги в этом случае усугубляются тяжелыми химическими ожогами. Любые операции с дисперсиями щелочных металлов, а также с металлическим калием справедливо считаются одними из самых опасных работ в химической лаборатории. Все эти металлы сходны по своим физико-химическим свойствам. Однако для разработки конкретных мер предосторожности при работе с ними необходимо знать их общие свойства и индивидуальные особенности.
Натрий(плотность 0,97 г/см3, температура плавления 97,7оС). Вследствие высокой химической активности натрия работа с ним в лаборатории представляет серьезную опасность. Натрий взаимодействует с кислородом воздуха при комнатной температуре с образованием оксида. Реагируя с влагой воздуха, оксид переходит в гидроксид. Куски натрия, оставленные на воздухе, быстро обрастают расплывающейся коркой гидроксида, что приводит к потере его активности. При мытье посуды водой в таких случаях иногда происходят взрывы, которые особенно опасны из-за их неожиданности. Во избежание несчастных случаев следует уничтожить остатки натрия сразу после их образования. Во влажном воздухе достаточно большие куски через некоторое время могут воспламениться. Дисперсии металлического натрия в углеводородах немедленно воспламеняются на воздухе при удалении растворителя. Со спиртами, особенно низшими, натрий реагирует весьма энергично. Присутствие воды в спирте значительно ускоряет реакцию взаимодействие этилового спирта, содержащего более 5% воды, с натрием небезопасно.
Поиск по сайту: |