 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Диссоциация воды. Водородный показатель
Степень диссоциации воды очень малая величина, поэтому количеством диссоциированных молекул пренебрегают. Поэтому, концентрацию недиссоциированных молекул можно считать постоянной величиной, её легко вычислить, разделив массу 1 л воды на молярную массу воды. Таким образом, уравнение диссоциации можно записать: [H+] · [OH-] = [H2O] · K (H2O) = 55, 56 · 1,8·10-16 = 1·10-14 Это произведение называется ионным произведением воды. Обозначается Іω = 10-14 Ионное произведение воды – постоянная величина для чистой воді и водных растворов разных электролитов. Bыражение ионного произведения воды имеет вид: · Для нейтральных растворов: · Для кислых растворов: [H+]>[OH-]>10-7моль/л; · Для щелочных растворов: [H+]<[OH-]<10-7моль/л. Водородный показатель рН – это десятичный логарифм молярной концентрации ионов водорода, взятый с противоположным знаком (показывает концентрацию ионов Н+ в растворе). Водородный показатель рН – показывает концентрацию ионов Н+ в растворе: рН = -lg [H+] (термин введен биохимиком Соренсеном при разработке способов улучшения контроля за качеством пива).
Определить реакцию среды по значению рН в следующих растворах:
Для практического использования чаще всего используют индикаторы. Кислотно-основные индикаторы – это органические вещества (слабые кислоты или слабые основания), способные к взаимодействию с ионами водорода или гидроксид-ионами. Их свободные анионы имеют неодинаковую окраску по сравнению с нейтральными молекулами. Диссоциация индикатора Н Іnd в водном растворе – равновесный процесс: Н Іnd ↔ Н+ + Іnd- Введение кислоты или щёлочи способствует смещению равновесия в сторону образования ионов или недиссоциированных молекул, которые способствуют изменению окраски самого индикатора.
Изменение цвета связано с изменением распределения электронной плотности в молекуле красителя. Так, при переходе из щелочной в кислую среду происходит протонирование одного из атомов азота азогруппы красителя. При этом из азогруппы – N = N –образуется новая группа – NН ‑ N= и изменяется строение ядра фрагмента азокрасителя:
метиловый оранжевый в кислой среде (розово-красный цвет)
Поиск по сайту: |

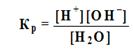

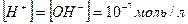





 рН сильных и слабых электролитов
рН сильных и слабых электролитов · Связь между водородным и гидроксильным показателями
рH + рОH = 14
· Концентрацию ионов водорода можно вычислить:
· Связь между водородным и гидроксильным показателями
рH + рОH = 14
· Концентрацию ионов водорода можно вычислить:
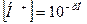
 · Концентрацию гидроксид-ионов можно вычислить:
[ОН-] = 10-рОН
[ОН-] =
· Концентрацию гидроксид-ионов можно вычислить:
[ОН-] = 10-рОН
[ОН-] =  Выводы:
ü В растворе сильной кислоты: [Н+] = Скисл.
ü В растворе сильного основания: [ОН-] = Соснов.
ü диссоциация сильного электролита – необратимый процесс.
Выводы:
ü В растворе сильной кислоты: [Н+] = Скисл.
ü В растворе сильного основания: [ОН-] = Соснов.
ü диссоциация сильного электролита – необратимый процесс.
 , где
Ккисл – константа диссоциации слабой кислоты;
Скисл – концентрация слабой кислоты.
Ø рН раствора слабой одноосновной кислоты можно вычислить:
, где
Ккисл – константа диссоциации слабой кислоты;
Скисл – концентрация слабой кислоты.
Ø рН раствора слабой одноосновной кислоты можно вычислить:
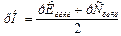 ,
рКкисл = ‑ lgKкисл; рСкисл = ‑ lgCкисл
Ккисл и Скисл – константа ионизации и концентрация слабой кислоты.
Для слабого основания:
Ø Концентрацию ионов водорода в растворе слабого основания вычисляют по формуле:
,
рКкисл = ‑ lgKкисл; рСкисл = ‑ lgCкисл
Ккисл и Скисл – константа ионизации и концентрация слабой кислоты.
Для слабого основания:
Ø Концентрацию ионов водорода в растворе слабого основания вычисляют по формуле:
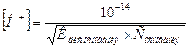 ;
Ø рН раствора слабого основания вычисляют:
рН = 14 – рОН, где рОН = ‑ lg [OH-].
[OH-] =
;
Ø рН раствора слабого основания вычисляют:
рН = 14 – рОН, где рОН = ‑ lg [OH-].
[OH-] =  ;
рН= ‑ ½ рКосн.– ½ lgСосн
Косн. и Сосн. – константа ионизации и концентрация слабого основания.
Выводы:
ü В растворе слабой кислоты: [Н+] < Скисл.
ü В растворе слабого основания: [ОН-] < Соснов.
ü диссоциация слабого электролита – обратимый процесс
;
рН= ‑ ½ рКосн.– ½ lgСосн
Косн. и Сосн. – константа ионизации и концентрация слабого основания.
Выводы:
ü В растворе слабой кислоты: [Н+] < Скисл.
ü В растворе слабого основания: [ОН-] < Соснов.
ü диссоциация слабого электролита – обратимый процесс








 HOSO3 ‑ ─ NH ─ N ═ ═ N+ CI-
HOSO3 ‑ ─ NH ─ N ═ ═ N+ CI- СН3
СН3