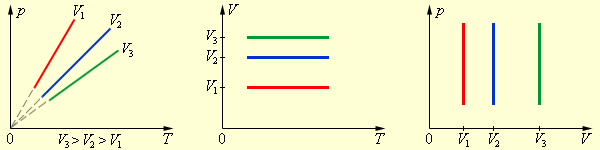|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Идеальные газы. Закон Менделеева-Клапейрона. Параметры веществаСтр 1 из 8Следующая ⇒
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; б) газ очень, разрежен, т. е. расстояние между молекулами намного больше размеров самих молекул; в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разрежении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. В качестве основных параметров состояния в термодинамике приняты давление, температура и удельный объём( объём). Если параметры не изменяются, то рабочее вещество находится в стабильном, равновесном состоянии; если один или несколько параметров меняется, осуществляется термодинамический процесс. Удельный объём (объём). Давление. Температура. (книга 8-9) Давление p, объем V и температура T идеального газа связаны между собой уравнением Менделеева–Клапейрона:
Здесь ν – количество вещества(моль), R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Если температура газа остается постоянной, то выполняется закон Бойля–Мариотта:
Если постоянным остается давление, то выполняется закон Гей-Люссака:
Наконец, если постоянен объем, то справедлив закон Шарля:
Закон Дальтона Давление смеси не взаимодействующих между собой газов равна сумме парциальных давлений каждого газа в отдельности
Парциальное давление - это давление компонента смеси, если бы он занимал весь предоставленный ему объем один.
Параметры — это свойства веществ, которые идентифицируют их термодинамическое состояние в определенное время. Термодинамическое состояние — это состояние вещества с точки зрения его давления, температуры, внутренней энергии, плотности, удельного объема, энтальпии и энтропии. Любые два параметра вещества определяют его термодинамическое состояние. Существует две категории термодинамических параметров: интенсивные и экстенсивные. Интенсивный параметр — это свойство, которое не зависит от количества или размера системы. Температура и давление — интенсивные параметры веществ и систем. Экстенсивные параметры зависят от количества или размера вещества или системы. Масса и объем — экстенсивные параметры. Из шести параметров пара, которые имеют особое значение при изучении охлаждения, давление, температуру и объем называют измеримыми параметрами, так как их можно непосредственно измерить инструментами. Внутренняя энергия, энтальпия и энтропия — это параметры, которые известны как исчислимые параметры. Измеримые и исчислимые параметры обычно приводятся в таблицах параметров. В таких таблицах перечисляют характерные параметры веществ при различных температурах или давлениях. Таблицами параметров пользуются специалисты, технологи и инженеры при настройке или анализе работы систем.
Поиск по сайту: |

 где m — масса вещества, M — молярная масса вещества.
где m — масса вещества, M — молярная масса вещества.