 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Переход реакционной системы из одного состояния равновесия к другому называется смещением или сдвигом химического равновесия
Влияние различных факторов на состояние равновесия качественно описывается принципом смещения равновесия, сформулированным французским физико - химиком Анри Ле Шателье: eсли на систему, находящуюся в равновесии производится какое-либо воздействие (изменяется концентрация, температура, давление), то равновесие смещается в направлении процесса, ослабляющего произведенное воздействие. Поясним на примере реакции синтеза аммиака:
(N2) + 3 (H2) 1)При увеличении концентрации хотя бы одного из реагентов равновесие смещается в сторону образования продуктов, а при добавлении продуктов – в сторону реагентов. Если увеличить концентрацию азота или водорода , то равновесие сместится вправо, в сторону расходования реагентов , в сторону уменьшения концентрации этих веществ. Увеличение концентрации NH3 сместит равновесие влево.
2)Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции, а понижение - в сторону экзотермической. Реакция синтеза аммиака идет с выделением тепла (экзотермическая), поэтому повышение Т смещает равновесие влево, а понижение- вправо. Однако в промышленных условиях синтез аммиака проводят при довольно высоких температурах т.к. при низких Т хотя и достигается больший выход целевого продукта, но скорость установления равновесия настолько мала, что экономичнее синтезировать аммиак с меньшим выходом, но за более короткий срок. Но снижение выхода компенсируется увеличением давления. Одновременное повышение t до 450-5500С и увеличение давления от 15 до100мПа ускоряет процесс достижения равновесия и увеличивает выход продукта.
3)Повышение давления в равновесной системе вызывает реакцию, сопровождающуюся уменьшением числа частиц в газовой фазе, равновесие смещается в сторону меньшего числа газообразных частиц. В данной реакции увеличение давления сместит равновесие вправо, а уменьшение - влево. Принцип Ле Шателье применим не только к гомогенным системам , но и к гетерогенным. Гомогенные реакции протекают в однофазной системе и во всем объеме, гетерогенные - в многофазной , на поверхности раздела фаз. В качестве примера рассмотрим гетерогенную реакцию восстановления оксида углерода (IV). С(тв ) + СО2(г) 1)Увеличение концентрации СО2(г) сместит равновесиевправо,а СОвлево. 2)Поскольку процесс эндотермический, то нагревание сместит равновесие вправо, в сторону увеличения выхода СО, а ее охлаждение - влево. 3)Повышение давления будет препятствовать протеканию прямого процесса, уменьшение - способствовать ему. З.д.м. применим к гетерогенным системам лишь с определенными допущениями. Рассмотрим гетерогенную реакцию термической диссоциации карбоната кальция.
CaCO3(тв) = CaO(тв) + СО2(г)
Если бы она протекала как гомогенная, то К = [CаО ] · [CО2] / [CаСО3], но [CаО] и [CаСО3] при данной температуре величины постоянные, очень малы. Тогда k1 = К ·[CаCО3] / [CaO] и k1 = [CО2] равновесная концентрация [CО2] при данной температуре является величиной постоянной, не зависящей от количеств CаО и CаСО3.
Поиск по сайту: |
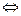 2 (NH3) DH0 = - 46кДж/моль
2 (NH3) DH0 = - 46кДж/моль