 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Вопрос 1. Обратимость химических реакций и понятие о химическом равновесии
Необратимыми называются реакции, которые протекают только в одном направлении и идут до конца. Различают практически и совершенно необратимые реакции. В практически необратимых преобладает реакция, идущая в одном направлении. Среди них выделяют несколько типов:
1.Реакции двойного обмена с образованием малорастворимого вещества NaCl + AgNO3 С1- + Ag+ 2.Реакции с образованием газообразных веществ Na2CO3 + CО32- + 2Н+ 3.Реакции с образованием малодиссоциирующих веществ HNO3 + KOH Н+ + ОН- = H2O 4.Ионные реакции окисления – восстановления Zn + H2SO4 Zn + 2H+ 5.Реакции, приводящие к образованию комплексных соединений
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O Сu2+ + 4NH4OH = [Cu(NH3)4] 2+ + 4H2O 6.Реакции, сопровождающиеся выделением большого количества энергии C6H12O6 + 6O2
Примеры совершенно необратимых процессов:
2КClO3 Pb(N3)2 (азид свинца)
(в обычных условиях нельзя получить бертолетову соль непосредственно из KCl и О2),а также нельзя провести синтез азида свинца из азота и свинца. Обратимыми называются реакции, которые протекают в противоположных направлениях и не идут до конца. Примеры обратимых реакций:
N2 + 3H2 C + CO2 N2 + O2 H2 + J2 PCl5 CO + Cl2 2NO + O2 {CH3COOH} + {C2H5OH} В ходе реакции устанавливается подвижное химическое равновесие, при котором скорости прямой и обратной реакции равны. Такое состояние системы реагирующих веществ , при котором скорости прямой и обратной реакций равны между собой называется химическим равновесием .
Для реакции в общем виде mA + nB → v1 ← v2 = k2 · [C] p · [D] g Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными, обозначаются при помощи квадратных скобок, в отличии от неравновесных. → ← В состоянии динамического равновесия v1 = v2 - кинетическая концепция равновесия. С течением времени v1 уменьшается, а v2- увеличивается. В некоторый момент они становятся равными.
k1 · [A]m · [B]n = k2· [C]p · [D]g
разделив обе части уравнения на k2, получим
Кс = k1/k2 = [ C]p · [D]g/ [A]m · [B]n Этим выражением определяется классическая константа равновесия Кс обратимого процесса, она равна отношению констант прямой и обратной реакцийКс = k1/k2
Константа Кс, отражающая соотношение концентраций компонентов обратимой реакции в состоянии динамического равновесия называется константой равновесия. Кс = [C]p · [D]g/ [A]m · [B]n –
Поиск по сайту: |
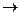 NaNO3 + AgCl
NaNO3 + AgCl 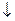
 2HCl
2HCl 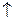
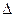 H0= -2867кДж/моль
H0= -2867кДж/моль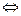 2NH3
2NH3