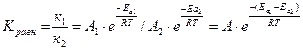|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Уравнение закона действующих масс в общем виде
Формулировка закона действующих масс (з.д.м.) для обратимых реакций: В данной обратимой реакции при данной температуре отношение произведений равновесных концентраций продуктов реакции и исходных веществ, возведенных в степени их стехиометрических коэффициентов есть величина постоянная. Кс показывает во сколько раз скорость прямой реакции больше скорости обратной, если концентрации каждого из реагирующих веществ равны 1 моль/л. В этом физический смысл константы равновесия. Константа равновесия определяет глубину протекания процесса в момент достижения состояния равновесия. Чем больше К, тем полнее происходит взаимодействие веществ. Зная К, можно вычислить теоретически возможный выход продуктов реакции. З.д.м. применим ко всем обратимым реакциям. Для гомогенных газов, реакций при небольших давлениях, когда газ подчиняется законам идеальных газов, вместо концентраций используют равновесные парциальные давления реагентов. Из уравнения Клапейрона – Менделеева Р = P = Cm · R · T Отношение числа моль n данного вещества к объему – молярная концентрация
См = n/V, P = Cм · R · T, См = P/R · T
Для реакции общего вида mA + nB константа равновесия Кp через парциальные давления может быть выражена как Кp = P Кp = [Сс ]р·[СD ]g / [CA ]m ∙ [CB]n ∙ RTDn Кp = Kc · R· TDn где Dn = (p+g) - (m+n)
Kc = Kp, если Константа диссоциации слабых электролитов (кислот и оснований), константа нестойкости комплексных ионов, ионное произведение воды, произведение растворимости – характеризуют обратимые процессы и являются константами равновесия.
Вопрос 2. Свободная энергия Гиббса и константа равновесия Условием принципиальной осуществимости процесса, т.е. возможности самопроизвольного протекания реакции в прямом направлении является неравенство DG0 < 0. Чем меньше DG0нуля , тем дальше система от состояния равновесия и тем более она реакционноспособна. Любая реакция может протекать самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Если в системе наступило истинное химическое равновесие, то дальнейшее изменение энергии Гиббса происходить не будет, т.е. DG0 = DH – T · DS = 0 если DG0 = 0, тогда DH = T · DS -энтальпийный фактор равен энтропийному, (термодинамическая концепция равновесия). Термодинамика дает важное соотношение между стандартной свободной энергией и константой равновесия, названное изотермой химической реакции
DG0 = -R · T · ln K = -2,3 · R · T · lg K при 298К(250С) это уравнение преобразуется к виду DG0 = -5,69 · lg K. Как видно из этих уравнений отрицательный знак DG0 возможен только в случае, если lgK> 0, т.е. К > 1, а положительный – если lgK <0, т.е. К < 1. Это значит, что при отрицательных значениях DG0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик, при положительном знаке DG0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал. Знак DG0 указывает на возможность или невозможность протекания реакции только в стандартных условиях. Чем значительнее убыль энергии Гиббса, тем больше константа равновесия. Константа равновесия связана с энтальпией системы. Из уравнения Аррениуса
k = A · e-Eа /R ·T В случае химического равновесия
Разность энергий активации прямой и обратной реакций равняется изменению энтальпии в результате взаимодействия Еа1 - Еа2 = DН, тогда
Кравн = А · е - DН /R·T –уравнение Вант - Гоффа, или в логарифмической форме lnK = lnA - DH/R · T Изменение температуры влияет на величину константы равновесия.
Поиск по сайту: |
 · R ·T
· R ·T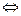 pС + gD
pС + gD · P ·
· P ·  /Р
/Р  · Р
· Р  ,
, Dn=0 .Константа равновесия – важнейшая характеристика химического взаимодействия .Для необратимых реакций К
Dn=0 .Константа равновесия – важнейшая характеристика химического взаимодействия .Для необратимых реакций К  ¥, т.к. равновесные концентрации продуктов реакции намного превышают концентрации исходных веществ. Она зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации (давления).
¥, т.к. равновесные концентрации продуктов реакции намного превышают концентрации исходных веществ. Она зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации (давления).