|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Катализатор – это вещество, изменяющее скорость химической реакции, но само в реакции не расходуется и в конечные продукты не входит
При этом изменение скорости реакции происходит за счет изменения энергии активации, причем катализатор с реагентами образует активированный комплекс. Катализатор после разрушения активированного комплекса не входит в состав продуктов реакции, поэтому общее уравнение процесса остается прежним. К Если гомогенная реакция В + А ® АВ протекает с малой скоростью, то можно подобрать вещество К, которое с одним из реагентов образует активированный комплекс, взаимодействующий в свою очередь с другим реагентом:
1/2О2 + NO = NO2 NO2 + SO2 = SO3 + NO А + К ® [ А….К ] [ А….К ] + В ® АВ + К
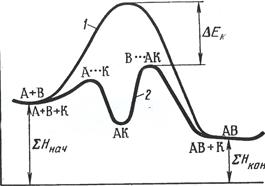
Если энергия активации этих стадий ниже энергии активации процесса в отсутствии катализатора, то общая скорость процесса значительно возрастает и такой катализ называется положительным, в противном случае скорость процесса уменьшится и катализ будет отрицательным, иначе называемый ингибированием.Отрицательные катализаторы – ингибиторы, которые отличаются от катализаторов тем, что входят в состав продуктов реакции. Энергетическая диаграмма хода реакции в отсутствии катализатора (кривая 1) и в присутствии катализатора (кривая 2). Очевидно, в присутствии катализатора энергия активации реакции снижается на величину ΔЕK..
Влияние катализатора на снижение энергии активации процесса Еа можно показать на следующих данных для реакции распада иодида водорода 2 HJ = H2 + J2 Еа , кДж/моль без катализатора 168 катализатор Au 105 катализатор Pt 59
Так как в выражении для константы скорости реакции энергия активации входит в отрицательный показатель степени, то даже небольшое изменение энергии активации вызывает очень большое увеличение скорости реакции. Так, для данной реакции уменьшение Еа на 40 кДж соответствует повышению скорости реакции при 500К в 30 000 раз.
Катализаторы обладают избирательностью(селективностью) :
Аl2O3 t= 350-3600С С2Н5ОН ® C2H4 + H2O дегидратация этанола
Cu t=200-2500С С2Н5ОН ® CH3COH + H2 дегидрирование
Подбирая катализатор получают необходимый продукт. Различают два вида катализа – гомогенный (однородный) и гетерогенный(неоднородный). При гомогенном катализе реагенты и катализатор образуют однородную систему – газовую или жидкую и между реагентами и катализатором отсутствует поверхность раздела. Примерами гомогенного катализа могут служить реакции между газами в присутствии газообразных катализаторов (NO2, H2O и др.) и между растворенными веществами в присутствии растворенного катализатора или растворителя. NO(г) SO2(г) + O2(г) → SO3 H2O(г) CO(г) + О2(г) → CO2 Если катализатор и реагенты находятся в разных фазах и процесс протекает на поверхности их раздела, то это гетерогенный катализ. Распространенными кристаллическими катализаторами являются металлы и их оксиды. Например: V2O3(Т) SO2(г) + O2(г) → SO3 MnO2(T) Н2О2(ж) → Н2О + О W(T) N2(г) + H2(г) → NH3 Ni(T) CH2 = CH2(г) + Н2(г) → C2H6 Как в гомогенном, так и в гетерогенном катализе действие положительных катализаторов сводится к уменьшению энергии активации реакции, к снижению высоты энергетического барьера. В присутствии катализатора образуется активированный комплекс с более низким уровнем энергии, чем без катализатора, и поэтому скорость реакции очень возрастает. Реакции с участием катализатора протекают при более низкой температуре, чем без него. Механизм гетерогенного катализа более сложен. В этом случае существенную роль играет поглощение поверхностью катализатора реагирующих частиц. При гетерогенном катализе исключительно большое значение имеет поверхность соприкосновения реакционной смеси с катализатором (площадь контакта). Так платина, взятая в виде пластинки, повышает скорость реакции в сотни раз меньше, чем тоже весовое количество металла в виде порошка. Начальными стадиями являются диффузия частиц исходных реагентов к катализатору и поглощение частиц его поверхностью (активированная адсорбция). Это вызывает сближение молекул и повышение их химической активности, при этом понижается активационный барьер. В результате на катализаторе происходит реакция. Затем продукты взаимодействия покидают катализатор и в результате диффузии переходят в объем. Таким образом, в гетерогенном катализе образуются промежуточные поверхностные соединения, которые формируются на активных участках (активные центры) катализатора. Активные центры составляют небольшую долю всей поверхности катализатора. Для увеличения поверхности катализатора и, тем самым, числа активных центров его нужно тонко измельчить. Некоторые вещества снижают активность или полностью дезактивируют твердый катализатор. Такие вещества называются каталитическими ядами. Вещества, которые усиливают действие катализаторов данной реакции, хотя сами катализаторами не являются, называются промоторами. Биологические катализаторы называются ферментами (энзимами). Они участвуют в химических процессах в растительных, животных организмах.
Ферменты – это особый класс белков, присутствие которых в небольших количествах жизненно необходимо для всех биологических организмов. Лучшие неорганические катализаторы по своей активности уступают ферментам в десятки тысяч раз и более.
Основные особенности ферментов как катализаторов следующие: 1) исключительно большая каталитическая активность Некоторые ферменты обладают поразительной эффективностью в чрезвычайно малых количествах. Одна молекула каталазы способна в течение одной секунды при О0С катализировать разложенные 50 000 молекул Н2О2. Лучшие неорганические катализаторы по своей активности уступают ферментам в десятки тысяч раз и более. Фермент ренин (сычужный фермент) представляет собой небольшую часть сычуга – желудка жвачных животных – и при изготовлении сыров катализирует коагуляцию молочного белка в количествах, превышающих в миллионы раз его собственный вес. В процессе каталитического действия молекула фермента каждый раз регенерируется и у типичных ферментов способна за одну минуту осуществлять миллионы единичных превращений.
2) высокая химическая специфичность Данный фермент сильно ускоряет ход одного процесса, но оказывается вовсе неактивным для другого. Подобно тому, как для каждого замка имеется один ключ, так и для каждой биологической реакции эффективным катализатором является лишь строго определенный фермент. Предполагается, что в организме человека одновременно функционирует около 1 000 ферментов. Действие каждого фермента в высшей степени специфично. Некоторые из них выполняют свою функцию внутри клетки, другие – вне ее. Находящийся в мышцах фермент лактат – дегидрогеназа катализирует окисление одного изомера молочной кислоты, но не воздействует на другой ее изомер.
3) инактивация В процессе реакции, активируемой данным ферментом каталитическая способность катализатора теряется. При этом установлена такая закономерность – чем активнее фермент как катализатор, тем он быстрее инактивируется в процессе реакции. Этим ферментативный катализ существенно отличается от неорганического. Значение биокатализа исключительно велико для сельского хозяйства. Так, процесс превращения не усвояемых растениями форм органических соединений почвы и удобрений (перегной, навоз, зеленые удобрения) в усвояемые идет ферментативным путем. Ферменты играют большую роль при прорастании зерна. Азот атмосферы становится доступным растениям в значительных количествах также за счет биокаталитических процессов.
Поиск по сайту: |