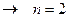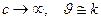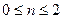|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Нанесенные адсорбционные катализаторы
- обычно готовят нанесением активного агента (например, Скелетные катализаторы. - готовят путем сплавления порошков металлов Кинетика гетерогенно-каталитических реакций Закон действующих поверхностей Химическое взаимодействие в гетерогенно-каталитическом процессе происходит между адсорбированными молекулами реагентов, как говорят, в адсорбционном слое. Тогда скорость реакции будет зависеть не от объемной, но от поверхностной концентрации реагирующих веществ, т.е. от величин адсорбции. Скорость гетерогенно-каталитической реакции пропорциональна произведению величин адсорбции (степеней заполнения) каждого из реагентов, т.е. Изотерма адсорбции Ленгмюра. Связь между поверхностной и объемной концентрацией реагирующего вещества устанавливается изотермой адсорбции. Если принять, что поверхность катализатора энергетически однородна, т.е.
Кинетика мономолекулярной реакции.
а) б) Кинетика бимолекулярной реакции.
а) б) Кинетика реакций в растворах . Уравнение Бренстеда – Бьеррума. Клеточный эффект
Молекулы растворённого вещества совершают нерегулярные колебания с периодом τ 0 в “клетке”, образованной соседними молекулами растворителя. Поколебавшись около одного положения равновесия в течение некоторого времени τ , частица перескакивает в соседнюю клетку, для чего она должна иметь энергию, большую некоторого порогового значения E. В рамках клеточной модели механизм жидкофазной реакции выглядит следующим образом: каждая из частиц скачками, следующими друг за другом через время τ , беспорядочно перемещается в среде растворителя. В результате перемещений происходят случайные встречи частиц, то есть попадание их в одну клетку жидкости, с образованием диффузионной пары. В клетке частицы испытывают колебания с периодом τo , во время которых они претерпевают соударения с молекулами растворителя и между собой. Если за время τ частицы не успевают прореагировать, то диффузионная пара распадается, и частицы снова расходятся. Таким образом, необходимым условием жидкофазной реакции является предварительное попадание частиц в результате диффузии в одну клетку, где частицы и реагируют в соударениях. Время пребывания в клетке обычно составляет 10–10 – 10–8с.
Поиск по сайту: |
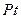 ) на пористый инертный носитель с высокоразвитой поверхностью. Обычно это делают посредством пропитки активированного угля, силикагеля, алюмосиликатов и др. пористых веществ растворами солей металлов с последующей просушкой и термической обработкой или восстановлением водородом.
) на пористый инертный носитель с высокоразвитой поверхностью. Обычно это делают посредством пропитки активированного угля, силикагеля, алюмосиликатов и др. пористых веществ растворами солей металлов с последующей просушкой и термической обработкой или восстановлением водородом. с алюминием и последующим растворением (выщелачиванием) последнего в щелочи. Остается «скелет», обладающий высокой пористостью и удельной поверхностью.
с алюминием и последующим растворением (выщелачиванием) последнего в щелочи. Остается «скелет», обладающий высокой пористостью и удельной поверхностью.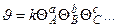
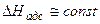 , то величина адсорбции описывается уравнением Ленгмюра:
, то величина адсорбции описывается уравнением Ленгмюра: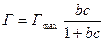 или
или  ,
, 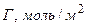 .
.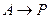 ,
, 
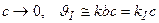

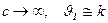
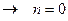 , т.о.
, т.о. 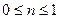
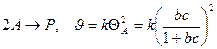 .
.