 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Кинетические особенности гетерогенной реакцииСтр 1 из 5Следующая ⇒
КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ
Гетерогенными называют процессы, протекающие на границе раздела фаз (растворение, кристаллизация, фазовые переходы, химические реакции на границе двух фаз По природе контактирующих фаз можно выделить 5 типов гетерогенных процессов: тв.-г., тв.-ж., тв.-тв., ж.-ж., ж.-г. Особенности гетерогенных реакций 1. Скорость гетерогенной реакции зависит от величины и состояния поверхности. Поэтому правильнее ее относить не к единице объема реакционной системы, а к единице поверхности раздела фаз, т.е. 2. Многостадийность гетерогенных реакций. а) Любая гетерогенная реакция включает, как минимум, 3 стадии: 1) подвод реагентов к границе раздела фаз 2) химическое взаимодействие на поверхности 3) отвод продуктов реакции в глубину объемной фазы Могут иметь место и другие стадии, например: адсорбция реагентов и десорбция продуктов, ассоциация или диссоциация молекул, дополнительные химические превращения реагентов вблизи поверхности раздела фаз (комплексообразование, димеризация, протонирование и др.) б) Если какая-либо из этих последовательных стадий протекает заметно медленнее, чем другие стадии, то именно она будет тормозить весь процесс и определять его скорость, т.е. являться лимитирующей стадией гетерогенного процесса. 3. Транспортные стадии, т.е. доставка реагентов в зону реакции и отвод продуктов осуществляются за счет диффузии. Диффузией называют перемещение молекул вещества в неподвижной среде под действием разности концентраций или, как говорят, градиента концентрации в результате теплового движения.
Кинетические особенности гетерогенной реакции 1. Кинетическая область, диффузионная область. 2. В зависимости от условий проведения, кинетика одной и той же реакции может определяться как процессами диффузии, так и скоростью самого химического взаимодействия. График зависимости 3. Области протекания реакции. а) Диффузионная, переходная, кинетическая б) Выяснение природы лимитирующей стадии 1) влияние температуры (температурный коэффициент константы скорости химической реакции ( 2) влияние перемешивания 4. Кинетика в переходной области. а) б) в) стационарный режим:
г) д) диффузионное и кинетическое сопротивление
е) анализ 1) 2)
Поиск по сайту: |
 , электрохимические реакции на границе электрод-раствор электролита, гетерогенные каталитические реакции).
, электрохимические реакции на границе электрод-раствор электролита, гетерогенные каталитические реакции). .
. в широком интервале температур.
в широком интервале температур.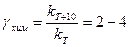 ) и диффузии (
) и диффузии ( 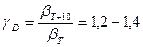 ), величина энергии активации
), величина энергии активации  )
) для мономолекулярной реакции
для мономолекулярной реакции ,
, 






