|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Гомогенный и гетерогенный катализ
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном и гетерогенном катализе. В последнем случае ускорение процесса обычно связано с каталитическим действием поверхности твердого тела (катализатора). Действие катализатора при любом виде катализа объясняется тем, что он вступает в промежуточное взаимодействие с реагирующими веществами, направляя процесс по новому пути с меньшей энергией активации.
Гомогенный катализ
Так называют каталитический процесс, в котором реакционная смесь и катализатор образуют одну фазу (газообразную или жидкую). Гомогенно-каталитические реакции особенно распространены при проведении процессов в жидкой фазе. Гомогенными катализаторами обычно служат растворы кислот, оснований, солей и прежде всего солей d-элементов (Cr, Mn, Fe, Co, Cu и др.). Явление катализа, в частности гомогенного, находит свое объяснение в теории промежуточных соединений. Эта теория исходит из того, что катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя с ним в той же фазе неустойчивое промежуточное соединение, которое отличается большой реакционной способностью. Далее промежуточное соединение энергично взаимодействует с другим компонентом реакционной смеси, и образуется конечный продукт. Катализатор при этом восстанавливается в первоначальном виде и количестве. Увеличение скорости реакции происходит за счет снижения энергии активации каждой из её отдельных стадий. Рассмотрим следующую каталитическую реакцию в общем виде:
А + В → АВ
Примем, что энергия активации этой реакции Е1 высока, и она протекает с очень малой скоростью. В присутствии катализатора К образуется промежуточное соединение АК, которое требует для своего образования меньшую энергию активации Е2, чем для непосредственного взаимодействия веществ, т.е. Е2 < Е1: А + К®А…К → АК (1.26) активный комплекс
Промежуточное соединение АК взаимодействует с веществом В, образуя АВ и К. В + АК → А…К…В → АВ + К (1.27) активный комплекс
Энергия активации этой стадии Е3 тоже меньше энергии активации некаталитического пути реакции, т.е. Е3 < Е1. Суммируя уравнения (1.26) и (1.27), получаем:
А + В → АВ,
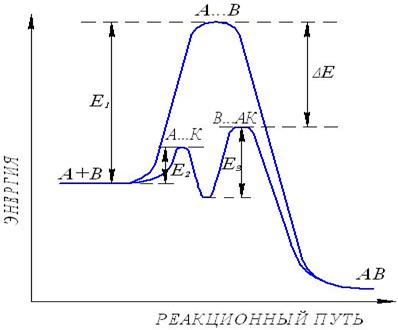
т.е. в результате реакции катализатор остался без изменения. Видно (рис.13), что энергетический барьер реакции без катализатора, характеризуемый величиной энергии активации Е1, при использовании катализатора разбивается на ряд более низких энергетических барьеров, характеризуемых энергиями активации Е2 и Е3, меньшими, чем Е1. Это обстоятельство обеспечивает повышение скорости реакции в сравнении с реакцией, идущей при тех же условиях, но без катализатора. ΔЕ – снижение энергии активации в присутствии катализатора. Если даже суммарная величина энергий активации промежуточных стадий Е2 и Е3 больше Е1, т.е. (Е2 + Е3) >Е1, то и в этом случае скорость реакции возрастет из-за того, что и Е2 и Е3 меньше Е1. Действие катализаторов может быть также проиллюстрировано рисунком 14, из которого видно, что снижение энергии активизации реакции приводит к возрастанию доли реакционноспособных (или активных) молекул (заштрихованная область).
Рис.13. Энергетическая схема реакции, протекающей с участием катализатора: А и В-исходные вещества; АВ-продукт реакции; АК-первое переходное со- состояние; ВАК-второе переходное состояние; Е1-энергия активации реакции; без катализатора; Е2-энергия активации образования первого переходного состо- ния; Е3-энергия активации образования второго переходного состояния.
Рис.14. Влияние катализатора на число активных молекул. DN/(NDE)-доля молекул с определенной энергией; Еа-энергия активации реакции без катализатора; Еа-энергия активации реакции в присутствии катализатора.
Примеры влияния катализатора на снижение энергии активации реакции: 2HI → H2 + I2
без катализатора 184 кДж/моль катализатор – Au 105 кДж/моль катализатор – Pt 69 кДж/моль
H2O2 → H2O + 0,5O2
без катализатора 75 кДж/моль катализатор – ионы I– 56 кДж/моль катализатор – Pt 49 кДж/моль
(катализаторами распада перекиси водорода являются также Mn, Cu, Fe, ионы этих металлов, MnO2 и др.; их влияние на скорость столь значительно, что процесс может носить взрывной характер);
CH3C(H)O → CH4(г) + CO(г)
без катализатора 190 кДж/моль катализатор – пары I2 136 кДж/моль
(скорость реакции при этом увеличивается в 100000 раз). Последняя реакция является одним из примеров гомогенного каталитического процесса CH3C(H)O + I2 → CH3I + HI + CO CH3I + HI → CH4 + I2
Выделяющийся в неизменном виде катализатор – I2 может стимулировать разложение следующей молекулы уксусного альдегида. Характер промежуточных соединений с катализатором различен. В кисло-основных реакциях, где электронные пары перемещаются без разобщения электронов (гетеролитический разрыв валентных связей), это, обычно, комплексы типа солей; в окислительно-восстановительных реакциях, в которых электронные пары разрываются (гомолитические или радикальные реакции), это, как правило, комплексы с участием молекул и ионов, содержащих металлы переменной валентности, прежде всего d-элементы. К первой группе относятся процессы, в которых катализатором служат кислоты и основания: это реакции присоединения или отщепления полярных молекул. В процессах второй группы перенос электронов осуществляется за счет попеременного окисления иона, содержащего металл. Хотя промежуточные продукты являются весьма реакционно-способными (это очень нестойкие соединения с малым временем жизни), во многих реакциях их удается выделять, доказывая тем самым их существование. Гетерогенный катализ
Если реакционная смесь и катализатор находятся в разных фазах, то процесс называется гетерогенным катализом. На практике наиболее часто встречаются два типа гетерогенного катализа: а) процессы, катализатор которых находится в твердой фазе, а реагирующие вещества – в жидкой; б) процессы, катализаторы которых находятся в твердой фазе, а реагирующие вещества – в газовой. Гораздо реже встречаются каталитические процессы с катализатором в жидкой фазе. Реагирующие вещества в этом случае могут находиться в жидкой или газообразной фазе. Жидкие катализаторы представляют собой кислоты (например, серная или фосфорная), иногда другие активные вещества в воде или органических растворителях. Рассмотрим некоторые особенности каталитических процессов с твердыми катализаторами. Распространенными гетерогенными катализаторами являются многие металлы, чаще всего переходные (Pt, Pd, Ni, Co, Cu, Fe, Mo и др.), их оксиды (Al2O3, CuO, NiO, ZnO, Cr2O3 и др.), соли и т.д. При гетерогенном катализе исключительно большое значение имеет поверхность соприкосновения реакционной смеси с катализатором, т.к. процесс протекает на поверхности раздела фаз. Так, платина, взятая в виде пластинки, повышает скорость реакции в сотни раз меньше, чем то же весовое количество металла в виде мелкого порошка. Поэтому применяют не сплошные массы катализатора, а его тонко измельченные, порошкообразные формы. Но порошкообразный катализатор легко уносится струей газа или жидкости, а взятый в больших количествах - создает значительное сопротивление потокам реакционной массы. Поэтому обычно активное вещество осаждают на инертных пористых подкладках – носителях (силикагеле, алюмогеле, солях и т.п.) или прессуют, придавая катализатору форму пористых таблеток, шариков или цилиндров. Гетерогенный катализ, по сравнению с гомогенным, является более сложным и состоит из нескольких стадий: 1) диффузия реагирующих веществ к поверхности катализатора; 2) адсорбция молекул на поверхности катализатора; 3) реакция на поверхности катализатора; 4) десорбция продуктов реакции; 5) диффузия продуктов реакции в объем. В зависимости от условий проведения процесса и его особенностей наиболее медленной может быть любая из стадий, которая и определяет скорость процесса в целом. Если скорость реакции на поверхности катализатора больше скорости диффузии, то скорость процесса будет определяться скоростью диффузии. В этом случае говорят, что процесс лежит в диффузионной области. Если скорость химической реакции меньше, чем скорость диффузии, то скорость процесса в целом будет определяться скоростью химической реакции. В этом случае говорят, что процесс лежит в кинетической области. Если скорость диффузии и скорость химической реакции соизмеримы, то в этом случае говорят о процессе в переходной области. Вторая, третья и четвертая стадии, совокупность которых и составляет собственно гетерогенный каталитический процесс, протекают с преодолением некоторых энергетических барьеров, т.е. молекулы на соответствующих стадиях должны обладать определенной энергией активации. Но все промежуточные стадии протекают с значительно меньшей энергией активации по сравнению с процессом без катализатора. Это и обусловливает увеличение скорости реакции в целом. Основу теории гетерогенного катализа составляет адсорбционная теория, согласно которой на поверхности катализатора происходит адсорбция, т.е. концентрирование реагирующего вещества. Адсорбция является результатом взаимодействия неуравновешенных сил поверхностных частиц твердого катализатора с молекулами реагирующего вещества газовой или жидкой фазы. Представим поверхность твердого тела на границе, например, с газом. Внутри твердого тела частицы (атомы, ионы или молекулы), образующие его решетку, правильно чередуются в соответствии с кристаллической структурой, причем их взаимодействия уравновешены. Состояние же частиц, находящихся на поверхности, иное – их взаимодействия не уравновешены, и поэтому поверхность твердого тела притягивает молекулы вещества из соседней газовой фазы. Газ адсорбируется поверхностью твердого тела (обратный процесс называется десорбцией), и в результате концентрация этого вещества на поверхности становится больше, чем в объеме системы в целом, что уже само по себе способствует повышению скорости, так как создаются лучшие кинетические условия – увеличивается вероятность соударения молекул. Кроме того, в результате взаимодействия отдельных атомов, составляющих молекулу реагирующего вещества, с атомами вещества - катализатора происходит ослабление внутримолекулярных сил в частицах реагирующих веществ, что приводит к их активации, увеличению их средней энергии и, таким образом, к уменьшению энергии активации реакции. Такая адсорбция получила название активированной, химической или хемосорбции. Иногда адсорбированные молекулы диссоциируют на отдельные атомы, отличающиеся большой химической активностью (например, водород на платине). Известны случаи, когда между адсорбированными молекулами и частицами адсорбента образуются неустойчивые химические соединения, легко вступающие в дальнейшие реакции. Адсорбционная теория объясняет, почему катализатор должен иметь максимальную поверхность на единицу веса: чем больше поверхность, тем количественно эффективнее идет процесс адсорбции, тем больше молекул реагирующих веществ активируются, и тем выше скорость реакции. Экспериментальные факты указывают на то, что адсорбция молекул реагирующих веществ и процесс формирования поверхностных соединений про- исходит не по всей поверхности, а только на отдельных участках катализатора, на так называемых активных центрах. Активные центры составляют совсем небольшую долю поверхности, что подтверждается действием каталитических ядов - веществ, блокирующих активные центры. Их ничтожное количество резко уменьшает активность катализатора или дезактивирует (отравляет) его полностью. Путем дозировки отравления можно определить число активных центров. Существенным является не только число активных центров, но и характер их расположения. Чем больше геометрическое соответствие между строением молекул адсорбируемых веществ и расположением активных центров на поверхности катализатора, тем активнее он себя проявляет. Если число активных центров или же их расположение (по рисунку или по расстояниям между ними) не соответствует геометрии молекул реагирующих веществ, процесс ускоряться не будет. В настоящее время представление об активных центрах является одним из основных качественных представлений в катализе. Вопрос о их природе (строении) является постоянным предметом научных исследований. Установлен ряд общих принципов выбора катализаторов для различных типов реакций. Во многих случаях определяющим фактором в их подборе является положение элементов в периодической системе Д.И. Менделеева. Примером гетерогенного катализа может служить применяющийся в промышленности контактный способ получения серной кислоты, при котором протекает реакция между газами SO2 и O2 на поверхности твердой фазы – катализаторе оксиде ванадия V2O5 по схеме:
1) SO2 + V2O5 → SO3 + 2VO2 2) 2VO2 + 0,5O2 → V2O5
Суммарно: SO2 + 0,5O2 → SO3
Другие примеры гетерогенного катализа: производство водорода из водяного газа (смесь СО и Н2О) – катализатором является оксид железа, активированный оксидом хрома; синтез аммиака из водорода и азота, катализируемый пористым железом, активированным оксидами калия, алюминия, кальция, кремния; производство метилового спирта из монооксида углерода и водорода – функцию катализатора выполняет смесь оксидов цинка и хрома (III); синтез углеводородов по Фишеру-Тропшу из смесей монооксида углерода с водородом в присутствии кобальта, железа или никеля; производство ароматических углеводородов (сырья для нефтехимического синтеза) из бензинов – катализатором является Pt на оксиде алюминия и т.д. Этот перечень можно продолжать очень долго, т.к. практически во всех производствах химической и нефтехимической промышленности используются катализаторы, и преимущественно гетерогенные.
Поиск по сайту: |