 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Z — число эквивалентности
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4. 8. Концентрированная серная кислота является окислителем за счёт серы. Она окисляет металлы, стоящие в ряду напряжений до серебра включительно. Продукты её восстановления могут быть различными в зависимости от активности металла и от условий (концентрация кислоты, температура). При взаимодействии с малоактивными металлами, например, с медью, кислота восстанавливается до SO2: Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O. При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород. Так, при взаимодействии с цинком могут протекать реакции: Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O 3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O 4ZN + 5H2SO4 = 4ZnSO4 + H2S + 4H2O. Органические вещества серная кислота обугливает, отнимая у них воду. При получении серной кислоты часть токсичного сернистого газа попадает в атмосферу и приносит большой вред растениям, здоровью человека и животных. Кроме того, образование кислотных дождей на 60% происходит из-за выбросов К тому же, кислотные дожди вызывают коррозию металлических (и не только) изделий. Помимо того, кислая вода растворяет соединения алюминия, ртути, свинца и т.п., которые отравляют гидросферу. Ежегодно в мире получают около 100 млн. т H2SO4, поэтому и вред от отходов ее производства окружающей среде очень большой. Тем более что выбросы Так что необходима очистка газообразных отходов от сернистого газа, как бы дорого это ни стоило. Ученые разработали достаточно эффективные химические методы очистки. Один из таких способов – пропускание газов, содержащих S
Предлагается также исключить обжиг сульфидов (т.е. пирометаллургический способ передела руд), а обрабатывать их водой, насыщенной кислородом, в вибраторе-смесителе (это гидрометаллургический метод). При этом, например, из пирита сразу получается 9. Истинный раствор –это равновесная однофазная система, состав которой можно плавно менять в определенных пределах без изменения числа фаз, причем частицами растворенного вещества являются молекулы, атомы или ионы. Раствор, находящийся в равновесии с растворяемым веществом, являетсянасыщенным, а концентрация раствора, насыщенного по данному соединению, называется его растворимостью (s).Произведение растворимости. Расчет растворимости. Рассмотрим систему, состоящую из осадка малорастворимого электролита, находящегося в равновесии с его насыщенным раствором. Это равновесие записывается в виде:
и характеризуется не только растворимостью (s), но и (более строго) с помощью
Неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Могут быть и восстановителями (кроме F) при взаимодействии с более электроотрицательными элементами. Получение простых веществ. Устойчивость галогенов в ст.ок. –1 от фтора к иоду снижается (из-за роста r). Поэтому, если
Но в промышленности для синтеза и I2, и Br2 берут более дешевый реагент – хлор:
Хлор в свою очередь получают из хлорида натрия электролизом его расплава, как и 2Na + Cl2 = 2NaCl Таким образом, галогенам присущи сильные окислительные свойства. Однако галогены (кроме F) могут проявлять и положительные степени окисления. Галогены - типичные неметаллы. Реакционная способность галогенов по отношению к металлам и водороду снижается от F к I. Более реакционноспособный галоген замещает менее реакционноспособнный в соединениях, например: 2KI + Cl2 = 2KCl + I2 2I- + Cl2 = 2Cl- + I2 Водородные соединения - галагеноводороды в воде являются кислотами: HF - фтороводородная (плавиковая) кислота HCl - хлороводородная (соляная) кислота HBr - бромоводородная кислота HI - иодоводородная кислота Сила этих кислот повышается от HF (слабая кислота) к HI (сильная кислота), так как в этом же направлении уменьшается энергия связи водород - галоген. 11. Процесс растворения электролитов (т.е. веществ, растворы которых проводят электрический ток) описывается теорией электролитической диссоциации, ее основные положения: а) при растворении электролит диссоциирует, т.е. распадается на ионы, б) диссоциируют вещества под действием молекул растворителя, в)продуктами растворения электролита являются сольваты (частицы, окруженные молекулами растворителя), в случае водных растворов – гидраты. Доказательством образования, в частности, гидратов служит выделение тепла при растворении в воде многих безводных солей, а также изменение оптических свойств (например, цвета) веществ после переведения их в раствор и др.Слабыми электролитами называют вещества, в 0,1М растворах которых наряду с ионами существуют и неионизированные молекулы ( Если 0,1М раствор не содержит молекул исходного вещества в недиссоциированном виде, т.е.
Ее величина определена по электропроводности чистой воды и при 220С равна
Подставляя данное значение а(Н2О) в выражение
здесь Перейдем к отрицательным десятичным логарифмам:
Отрицательный логарифм активности ионов водорода называется водородным показателем и обозначается
Для чистой воды (и нейтрального раствора): Азот и фосфор
Поиск по сайту: |
 . Величина pH дождевой воды доходит до 1,5, т.к. в атмосфере в присутствии промышленной пыли сернистый газ окисляется до триоксида, который под действием влаги дает H2SO4. Как следствие, pH воды в озерах снижается иногда до 4 (а норма 8). В такой среде невозможна жизнь не только рыб и водорослей, но даже микроорганизмов.
. Величина pH дождевой воды доходит до 1,5, т.к. в атмосфере в присутствии промышленной пыли сернистый газ окисляется до триоксида, который под действием влаги дает H2SO4. Как следствие, pH воды в озерах снижается иногда до 4 (а норма 8). В такой среде невозможна жизнь не только рыб и водорослей, но даже микроорганизмов. в атмосферу происходят не только на предприятиях, производящих серную кислоту, но и на других. В частности, на Норильском металлургическом комбинате, где обжигают сульфиды: CoS, NiS и т.п. (чтобы затем получать соответствующие металлы). Здесь ПДК (предельно допустимая концентрация)
в атмосферу происходят не только на предприятиях, производящих серную кислоту, но и на других. В частности, на Норильском металлургическом комбинате, где обжигают сульфиды: CoS, NiS и т.п. (чтобы затем получать соответствующие металлы). Здесь ПДК (предельно допустимая концентрация)  в воздухе превышена многократно, и вокруг Норильска тундра загублена...
в воздухе превышена многократно, и вокруг Норильска тундра загублена...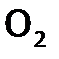 , через водную суспензию известняка:
, через водную суспензию известняка: .
.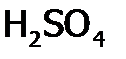 (но разбавленная, и ее надо концентрировать), а также оксид
(но разбавленная, и ее надо концентрировать), а также оксид  – его можно использовать в металлургии. Подобные безотходные технологии – будущее промышленности.
– его можно использовать в металлургии. Подобные безотходные технологии – будущее промышленности.
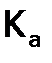 , которая называется произведением растворимости (ПР):
, которая называется произведением растворимости (ПР): , где, напомним, a=f∙C.
, где, напомним, a=f∙C.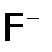 можно окислить лишь электротоком, то
можно окислить лишь электротоком, то 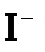 даже бромом:
даже бромом: .
. .
.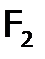 из
из  . Однако с гораздо меньшим расходом электроэнергии, поскольку окислить
. Однако с гораздо меньшим расходом электроэнергии, поскольку окислить 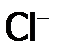 значительно легче, чем
значительно легче, чем  . . В свободном состоянии галогены состоят из двухатомных молекул F2, Cl2, Br2, I2. Атомы в этих молекулах связаны между собой неполярной ковалентной связью. На наружном энергетическом уровне находятся семь электронои ns2np5. До устойчивого состояния атомов им не хватает по 1 электрону. Поэтому атомы галогенов легко присоединяют электрон и проявляют степень окисления -1, например:
. . В свободном состоянии галогены состоят из двухатомных молекул F2, Cl2, Br2, I2. Атомы в этих молекулах связаны между собой неполярной ковалентной связью. На наружном энергетическом уровне находятся семь электронои ns2np5. До устойчивого состояния атомов им не хватает по 1 электрону. Поэтому атомы галогенов легко присоединяют электрон и проявляют степень окисления -1, например: ). К ним относятся гидрат аммиака, все органические основания и кислоты; из неорганических кислот:
). К ним относятся гидрат аммиака, все органические основания и кислоты; из неорганических кислот:  ,
, 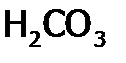 ,
,  ,
, 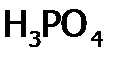 ,
, 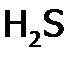 ,
, 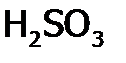 и т.п.
и т.п. , то электролит называют сильным. Это почти все растворимые основания (т.е. щелочи) и соли, а также неорганические кислоты (в которых, как правило, анионообразующий элемент, находясь в высшей ст.ок., имеет достаточно высокую электроотрицательность):
, то электролит называют сильным. Это почти все растворимые основания (т.е. щелочи) и соли, а также неорганические кислоты (в которых, как правило, анионообразующий элемент, находясь в высшей ст.ок., имеет достаточно высокую электроотрицательность):  ,
,  ,
,  и т.п Константа равновесия этого процесса, т.е. константа диссоциации Н2О:
и т.п Константа равновесия этого процесса, т.е. константа диссоциации Н2О: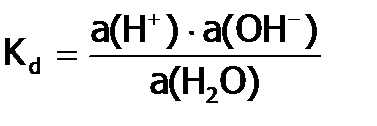 .
. . Так как степень диссоциации Н2О очень мала, то можно считать, что
. Так как степень диссоциации Н2О очень мала, то можно считать, что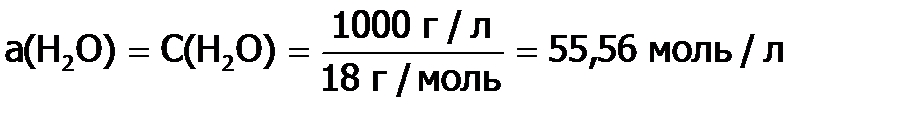 .
. воды, получим:
воды, получим: ;
; – ионное произведение воды:
– ионное произведение воды:  .
. .
. , а ионов гидроксила –
, а ионов гидроксила –  , таким образом, имеем:
, таким образом, имеем: .
. , для щелочной среды:
, для щелочной среды:  , а
, а  ; для кислого раствора – наоборот. Например, в 0,1М HCl:
; для кислого раствора – наоборот. Например, в 0,1М HCl:  (<7), а
(<7), а 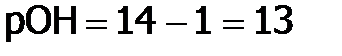 (>7).
(>7).