 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ПЛАЗМЕННЫЕ БЕЛКИ ГЕМОСТАЗА
Плазменные белки гемостаза образуют 2 ферментативные системы крови, имеющие своей целью поддержание гемостатического баланса (рис. 31): 1. Система свертывания плазмы. Система со 2. Система фибринолиза. Конечной целью этой • В обеих системах происходит многоэтапный ферментативный процесс актива- ции, в котором участвует ряд белков - про-теаз. • По крайней мере, in vitro имеется несколько • Многие реакции нуждаются в наличии спе Кроме каскадных систем свертывания плазмы и фибринолиза, к плазменным белкам гемостаза относятся многочисленные ингибиторы и активаторы, эффекты которых проявляются как действие антикоагулянтов или прокоагулянтов и соответственно ингибиторов или активаторов фибринолиза.
Рис. 31. Система свертывания крови и система фибринолиза- каскадные протеолитические ферментативные системы, обеспечивающие гемостатический баланс крови Плазменные белки гемостаза Система свертывания плазмы
Система свертывания плазмы - ферментативная система, осуществляющая каскад протео-литических реакций, в результате которых происходит образование фибриновой пробки в месте повреждения сосуда. Система свертывания тесно связана с другими протеолитическими системами плазмы, в том числе с системой фибри-нолиза. Белки свертывания плазмы, входящие в каскад свертывания крови, принято называть термином «фактор». В соответствии с международной номенклатурой факторы свертывания плазмы обозначаются римскими цифрами (табл. 6). Активные формы факторов обозначаются теми же римскими цифрами, но с добавлением аббревиатуры «а». Практически все факторы системы свертывания крови циркулируют в кровотоке в форме неактивных проэнзимов или в форме неактивных кофакторов. Исключение составляет фак- тор VII, примерно 1-2% которого в норме циркулируют в активной форме. При запуске свертывания крови происходит каскадная активация проэнзимов и кофакторов (рис. 32). Процесс активации представляет собой ограниченный протеолиз неактивных предшественников до активных энзимов и кофакторов. Активированные энзимы являются сериновыми протеа-зами (за исключением фактора XIII). Активированные кофакторы, не обладая самостоятельной ферментативной активностью, играют роль коферментов. Сериновыми протеазами являются активированные факторы II, VII, IX, X, XI, XII, ПК. Трансглютаминаза - фактор XIII. Кофакторы - факторы V, VIII, ВМК. Содержание компонентов гемостаза, в том числе плазменных факторов свертывания, в системе циркуляции существенно больше, чем необходимо
При разработке первой номенклатуры были использованы римские символы факторов от Iдо XIII.Для обозначения участия в свертывании плазмы тканевого фактора и ионов кальция им были приданы символы соответственно IIIи IV. Однако в настоящее время римская нумерация для них не используется, так как они не относятся к плазменным факторам свертывания (тканевой фактор - это тканевой компонент вне сосудистой системы, ионы Са не являются белком). Фактор VI в классификации не употребляется, так этим символом ошибочно был назван фактор Va. Плазменные белки гемостаза
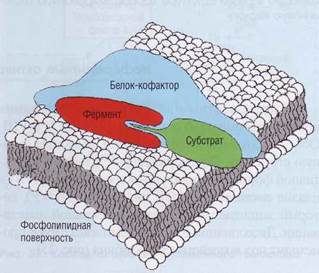
Рис. 32. Протеолитическая активация факторов гемостаза.Путем ограниченного протеолиза из неактивного предшественника образуются активный пептид и активированный фермент для формирования фибринового сгустка. Процесс свертывания происходит в условиях насыщения субстратами (рис. 33). Вследствие этого образование гемостатического тромба может быть достигнуто при значительном диапазоне концентрации и активности конкретного фактора свертывания. Клинические проявления недостаточности компонентов свертывания возникают при их существенном уменьшении, если обратиться к рис. 33 - то это начальный диапазон, при котором скорость реакции зависит от концентрации фактора. Для эффективного взаимодействия и активации белков свертывания крови необходимо образование комплексов этих белков, их кофакторов и субстрата (рис. 34). Эти условия не могут возникнуть в жидкой фазе. Поэтому большинство процессов активации промежуточных факторов свертывания протекают на фосфолипидах клеточных мембран. В месте сборки комплексов происходит концентрация факторов свертывания. Здесь же присутствуют кофакторы, которые существенно ускоряют процесс формирования сгустка. В создании активного комплекса участвуют: • Фермент (активный плазменный фактор - • Субстрат (профермент). • Активированный кофактор. • Ионы Са (Са2+). • Кислые фосфолипиды и специфические ре Все белки системы свертывания крови можно разделить на две группы. Одни белки для полноценного формирования требуют наличия витамина К (витамин-К-зависимые белки), а другие - нет. Рис. 33. Соотношение между концентрацией факторов и скоростью процесса свертывания.В норме скорость коагуляции практически не определяется концентрацией факторов, так как они присутствуют в избытке и процесс идет в состоянии насыщения. Только после значительного истощения фактора его концентрация будет влиять на скорость реакции и соответственно на скорость свертывания плазмы
Рис. 34. Модель сборки комплекса факторов свертывания крови.На поверхность твердой фазы (фосфолипиды фибробластов, макрофагов, активированных тромбоцитов либо, в патологических ситуациях, мембраны поврежденных клеток, бактерий и др,) прикрепляется (интернали-зуется) крупный кофакторный белок, который организует место контакта факторов свертывания, те в свою очередь взаимодействуют друг с другом по принципу комплементарности
Плазменные белки гемостаза Витамин-К-зависимые белки
Витамин-К-зависимыми белками являются ф.II, -VII, -IX, -X, протеины С и S. Эти белки синтезируются в печени и имеют сходную структуру молекулы (рис. 35). Характерной их особенностью является наличие уникальной аминокислоты -у-карбоксиглутамина. Эта аминокислота образуется во время синтеза витамин-К-зависимых белков в печени путем у-карбоксилирования глута-мина ферментом у-карбоксиглутаминпептидазой, в работе которого принимают участие активированные формы витамина К (рис. 142). у-карбок-сиглутамин дает возможность витамин-К-зависи-мым белкам с помощью ионов Са2+ образовывать комплексы с кислыми фосфолипидами. Рис. 35. Структурная организация некоторых плазменных белков системы гемостаза.Стрелками показаны места протеолитического гидролиза, в результате которого происходит переход неактивных проферментов в активные ферменты - сериновые протеазы каскада коагуляции. Двузубцем обозначены витамин-К-зависимые факторы, имеющие в своей структуре карбоксилированную глюта-миновую кислоту Неферментные активаторы свертывания крови К неферментным активаторам свертывания крови (коферментам) относятся факторы V и VIII. Оба - высокомолекулярные белки, имеющие сходную структуру. Они циркулируют в плазме в неактивной форме и активируются тромбином. ф.VIII в плазме связан с фактором Виллебранда (vWF), который защищает его от преждевременной инактивации. Диссоциация фVIII из комплекса с vWF происходит под воздействием тромбина (рис. 25). ф.Va и -Villa образуют на фосфолипидных мембранах комплексы с ф.Ха и -IХа соответственно. Специфическая активность ф.Ха и -IХа в комплексах с кофакторами в десятки тысяч раз больше, чем изолированных. Основным ингибитором ф.Va и -VIIIa является комплекс протеин С - протеин S. Классический коагуляционный каскад активации тромбина Изучение процесса свертывания крови до настоящего времени происходит в основном in vitro в смоделированных условиях. Исследование взаимодействия плазменных белков гемостаза в отрыве от других компонентов привело к созданию так называемой «классической» теории коагуля-ционного каскада активации тромбина. В насто- ящее время эта теория пересмотрена с учетом вновь полученной информации о взаимодействии различных компонентов гемостаза. Однако базовые принципы изложенной ниже классической каскадной теории считаются верными до настоящего времени. Кроме того, знание классического каскада свертывания крови необходимо для пра-
Плазменные белки гемостаза вильнои интерпретации результатов коагулоло-гических тестов. Активация протромбина - многостадийный процесс, который происходит по механизму про-ферментно-ферментного преобразования. С одной стороны, это обеспечивает нарастание сигнала: активация одной молекулы предшествующего уровня в системе свертывания приводит к активации от нескольких десятков до нескольких сотен тысяч последующих молекул (рис. 36). С другой стороны, многостадийность позволяет более гибко регулировать процесс. В классическом каскаде свертывания крови выделяют 2 пути активации процесса:
• Активация тканевым фактором (ТФ). Так как • Активация ф.ХII при контакте с отрицатель
ренний путьсвертывания (все факторы присутствуют в плазме в норме). Внешний и внутренний пути взаимодействуют между собой, а их разделение достаточно условно. Внешний и внутренний пути сходятся на факторе X. Последний со своим кофактором ф.Vа образует протромбиназу- ферментативный комплекс, который активирует протромбин с образованием тромбина. Образовавшийся тромбин поступает в ток крови и активирует фибриноген до фибрин-мономеров. Последние спонтанно соединяются, образуя полимеры фибрина. Условно свертывание плазмы (крови) делится на 2 основные фазы: 1) многоступенчатый этап, приводящий к акти
2) конечный этап, в котором под влиянием тром
Внешний путь образования протромбиназы Внешний путь образования протромбиназы короткий, что ведет к быстрому образованию тромбина. При контакте ТФ и ф.VIIа формируется комплекс, который активирует ф.Х. Фактор Ха при участии фактора Va, в присутствии ионов Са2+, на отрицательно заряженной фосфолипидной поверхно- сти формирует протромбиназу. В настоящее время полагают, что внешний путь - основной физиологический путь запуска процесса свертывания крови. Подробно его значение будет описано в разделе «Современная теория свертывания крови». Активность внешнего пути поддерживается за счет механизма положительной обратной свя-
Плазменные белки гемостаза
зи (рис. 38). Положительная обратная связь включается на нескольких этапах каскада свертывания. Наиболее существенными являются активация тромбином факторов VII и V. Рис. 38. Внешний каскад свертывания крови.Начинается с контакта крови с тканевым фактором (ТФ), который, взаимодействуя с ф.VIIа, образует комплекс, активирующий ф,Х, Усиление активности внешнего каскада свертывания крови обеспечивается 2 механизмами положительной обратной связи
Внутренний путь образования протромбиназы. Факторы контактной активации
Факторы контактной активации - ф.ХII, пре-калликреин, высокомолекулярный кининоген, С1-ингибитор - синтезируются в печени. In vitro эти белки участвуют в активации внутреннего каскада свертывания. В лабораторных условиях активация происходит на некоторых небиологических отрицательно заряженных поверхностях, например на стекле, каолине, кремнии, сульфате декстрана, а также в присутствии эллаговой кислоты. Имеются данные, что важным механизмом активации контактных факторов является их взаимодействие с поверхностью, характеризующейся свойствами твердой фазы. В патологических условиях контактная активация, вероятно, происходит на мембранах клеток крови и эндотелия, а также при контакте с коллагеном субэндотелия. Схематично взаимодействие белков при контактной активации показано на рис. 39. Видимо, в «подходящих условиях» происходит аутоактивация и взаимоактивация ф.ХII, ПК до активных ферментов. In vitro активация контактной системы приводит к активации ф.ХI, который в свою очередь активирует ф.IХ, образующий с ф.VIII теназный комплекс. Теназный комплекс (название комплекса происходит от английского слова ten - десять) активирует ф.Х, а далее процесс свертывания идет по уже описан- ному пути. Поскольку сборка теназного комплекса происходит на фосфолипидной поверхности, для нее необходимо присутствие ионов кальция. Контактная фаза активации поддерживается положительной обратной связью. Тромбин активирует ф.VIII и -XI. Физиологическое значение контактной активации, роль факторов контактной активации в процессе свертывания крови, физиологические активаторы и условия активации этих факторов в организме требуют дальнейшего изучения.
Рис. 39. Контактная фаза активации плазменных факторов.Контакт с поверхностью твердого тела вызывает активацию фактора XII, который запускает каскад свертывания плазмы, каскад активации фибринолиза, активацию калликреин-кининовой системы (положительная обратная связь) и активацию системы комплемента (отрицательная обратная связь) Плазменные белки гемостаза Классическая теория свертывания крови оставляла слишком много вопросов и противоречила клиническим данным. Например, с одной стороны, было неясно, какая поверхность в физиологических условиях является активатором, с другой стороны, почему дефицит факторов внутреннего пути (ф.VIII, -IX, -XI) приводит к выраженной кровоточивости при нормальной активности факторов внешнего пути, а глубокий дефицит факторов контактной активации, как правило, не сопровождается геморрагическим синдромом. В современной каскадно-матричной теории гемостазаэти противоречия разрешены. С современной точки зрения, контактная активация играет большую роль во взаимодействии системы свертывания крови с другими протеоли-тическими системами крови (фибринолитичес-кой, ангиотензин-рениновой, калликреин-кини-новой, системой комплемента и др.). В настоящее время изучены следующие функции белков контактной активации: 1. Брадикинин стимулирует повышение внутри • Вазодилатации и снижению артериально • Активации системы фибринолиза путем • Ингибированию активации тромбоцитов. • Стимуляции репарации и росту гладкомы-
2. Прямое ингибирование тромбин-индуциро- 3. Активация фибринолиза.
• Непосредственная активация плазмино • Активация калликреином проурокиназы
4. Блокада клеточной адгезии. 5. Антиангиогенное действие. 6. По-видимому, контактная активация играет Внутренний путь образования протромбиназы (рис. 40) включает активирующее действие ф.ХПа на ф.Х1, который в свою очередь активирует ф.1Х. Поскольку значение контактной активации в процессе свертывания крови переосмыслено, физиологическая роль ф.Х1 изучается. Видимо, в физиологических условиях ф.Х1 в основном активируется тромбином. ф.Х1 довольно устойчив к инактивации ингибиторами и имеет длительный период полувыведения. Образовавшись в достаточном количестве, ф.Х1 увеличивает количество активного ф.1Х, за счет чего соответственно значительно возрастает концентрация тромбина, который в свою очередь активирует по механизму положительной обратной связи ф.1Х, -VIII и -V. В то же время избыток тромбина тормозит начало процесса фибри-
Рис. 40. Внутренний каскад активации плазменного гемостаза.Начинается с взаимной активации контактных факторов системы гемостаза, Фактор XIIа переводит фактор XI в ХIа. Фактор ХIа активирует фактор IX. Все последующие этапы активации свертывания по внутреннему пути требуют ионов Са2+ и зависят от присутствия фосфоли-пидов. Фактор IХа активирует фактор X, но эта реакция не очень эффективная. Однако появившийся тромбин активирует фактор VIII. Активный фактор Villa вместе с фактором IХа, ионами Са2+ и фосфолипидами очень эффективно активирует фактор Ха, Обратная связь поддерживает развитие процесса за счет активации тромбином ф.VIII, -IX и -V
Плазменные белки гемостаза
нолиза за счет активируемого тромбином ингибитора фибринолиза (TAFI). Ингибитор С1-компонента комплемента (С1-ингибитор) является элементом системы контактной активации. Помимо комплемента, он ингибирует ф.ХIIа (см. раздел «Ингибиторы системы свертывания крови»). Другим ингибитором процесса контактной активации в физиологических условиях является апротинин. Рис. 41. Теназный и протромбиназный комплексы.Образование этих комплексов сопровождается резким увеличением активации соответственно фактора X и протромбина (фактор II)
Поиск по сайту: |








 Внутренний путь активации свертывания начинается с активации контактных факторов коа-гуляционного каскада: ф.ХII, прекалликреина и высокомолекулярного кининогена.
Внутренний путь активации свертывания начинается с активации контактных факторов коа-гуляционного каскада: ф.ХII, прекалликреина и высокомолекулярного кининогена.

