|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Роль эндотелия в регуляции сосудистого тонуса
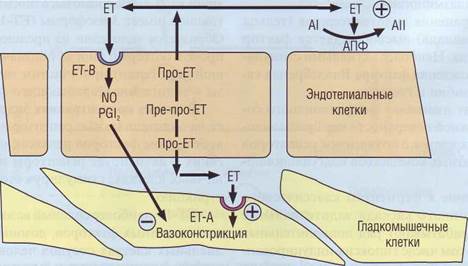
В течение нескольких секунд после повреждения сосудистой стенки происходит сокращение поврежденного и соседних кровеносных сосудов, свободные края сосуда вокруг повреждения вворачиваются внутрь кровеносного русла, при этом кровоток в месте повреждения частично перекрывается. Ведущую роль в модуляции этих изменений выполняет эндотелии. Эндотелии (ЕТ) - пептидный гормон, состоящий из 21 аминокислоты, относится к группе ци-токинов, имеет 3 изоформы (ЕТ-1, ЕТ-2 и ЕТ-3). Образуется эндотелии из предшественника пре-про-ЕТ (который иногда обозначается как большой эндотелии) при участии металлопептида-зы - эндотелинпревращающего фермента. В низких концентрацияхэндотелии действует на эндотелиальные рецепторы, вызывая высвобождение факторов релаксации, а в более высоких- активирует рецепторы на гладких мышечных клетках, стимулируя стойкую вазокон-стрикцию. ЕТ-1 - наиболее сильный вазоконстриктор из всех известных факторов, доминирует в эндотелиальных клетках сосудов человека. Он также присутствует в небольших количествах в гладких мышечных клетках (ГМК) и кардиомиоцитах. ЕТ не хранится в клетках, а постоянно синтезируется de novo. Синтез ЕТ и освобождение его из эн- Сосудистая стенка
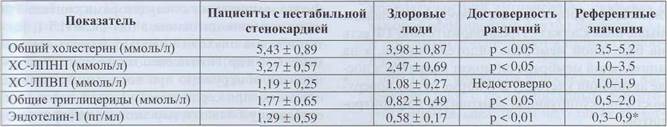
дотелиальных клеток стимулируют тромбин, адреналин, ангиотензин, вазопрессин, некоторые цитокины. Большая часть ЕТ секретируется внутрь сосудистой стенки, где расположены специфичные высокоаффинные рецепторы. ЕТ, секретируе-мый наружу, взаимодействует с собственными рецепторами на клеточной мембране, а также стимулирует ангиотензинпревращающий фермент (АПФ), который переводит неактивный ангиотензин I в вазоконстриктор ангиотензин II (рис. 11). Рецепторы для эндотелина сопряжены с G-бел-ками, присутствуют в 2 формах: ЕТ-А и ЕТ-В. Рецепторы ЕТ-А характеризуются высокой аффинностью и постоянно экспрессированы в миокарде на ГМК сосудов. Они обеспечивают прямое вазоконстрикторное действие эндотелина за счет активации поступления Са2+ в клетку через неселективные ионные каналы. Рецепторы ЕТ-В экспрессированы на эндотелиальных клетках и ГМК в отдельных сосудистых бассейнах. Стимуляция ЕТ-В сопровождается освобождением N0 (вазодилататор), тромбоксана (вазоконстриктор) и PGI2 (вазодилататор). Таким образом, один и тот же фактор реализует две противоположные сосудистые реакции (сокращение и расслабление), вызываемые различными химическими механизмами. Доказано, что дисбаланс эндотелий-зависимой сократимости и релаксации сосудов при артериальной гипертензии может способствовать повышению общего периферического сопротивления сосудов (ОПС) и появлению сердечно-сосудистых осложнений. Характерно увеличение эндотелина крови с возрастом. Наиболее высокий уровень эндотелина отмечен при атеросклерозе, неспецифическом аортоартериите, облите-рирующем тромбангиите, т. е. при заболеваниях, протекающих с повреждением эндотелия. Поскольку эндотелии действует преимущественно местно, естественно предположить, что повышенное образование и поступление его в кровь может быть причиной возникновения и усугубления тяжести течения ИБС. Мы исследовали чувствительность лабораторных тестов повреждения сердечно-сосудистой системы у пациентов с нестабильной стенокардией (п = 11, возраст 60,7 ± 9,9 года) в состоянии компенсации. Все пациенты в течение, по крайней мере, 1 года находились на низкокалорийной диете и корригирующей терапии гиполипидемически-ми препаратами, в том числе статинами. В группу сравнения входили практические здоровые люди (п = 13), средний возраст которых был 27,4 ± 1,5 года. Результаты измерений уровня эндотелина-1 и липидных показателей сыворотки представлены в табл. 2.
Рис. 11. Эндотелии - основной вазоконстриктор сосудистой стенки,вырабатывается и реализуется сосудистым эндотелием. ЕТ - эндотелии, AI и АII - ангиотензин I и II, АПФ - ангиотензинпревращающий фермент, ЕТ-А и ЕТ-В - рецепторы к эндотелину
Сосудистая стенка Таблица 2 Сравнительная характеристика эндотелина и липидов у пациентов с нестабильной стенокардией
Значения приведены из инструкции к набору Parameter-Human Endothelin-1 Assay производства R&D System Inc., США. У пациентов с нестабильной стенокардией после длительного срока наблюдения и интенсивной терапии (более 1 года приема статинов) удалось достичь целевых уровней основных показателей липидограммы для вторичной профилактики сердечно-сосудистых заболеваний, хотя эти показатели были выше, чем у здоровых молодых людей. В то же время уровень ЕТ-1 у пациентов был выше не только показателей группы сравнения, но и рекомендуемого референтного значения. Это расценивается как свиде- тельство того, что, несмотря на интенсивную терапию, у больных сохраняется активный процесс дисфункции эндотелия. Поэтому пациенты с нестабильной стенокардией, даже при условии нормализации показателей липидного обмена, должны быть под наблюдением кардиолога. В свою очередь, определение ЕТ-1 можно рекомендовать в качестве лабораторного теста активности процесса повреждения сосудистой стенки и, следовательно, прогноза течения болезни. Субэндотелий В состав субэндотелиальной базальной мембраны (рис. 12) входят различные типы коллагена, фибронектин, витронектин, ламинин, про-теогликаны, гликозаминогликаны, тромбо-спондин, фактор Виллебранда, а в местах повреждения и воспаления - фибрин. Большая часть этих компонентов синтезируется и секре-тируется эндотелиальными клетками, однако перициты и ГМК также вносят свой вклад в формирование внеклеточного матрикса. Внеклеточные белки субэндотелия играют важную роль в межклеточном взаимодействии, формировании скелета сосуда, процессе клеточной адгезии, репарации и росте сосудов. Субэндотелий является стимулятором адгезии тромбоцитов и активации каскадной системы свертывания крови. Прокоагулянтные свойства клеток субэндотелия (макрофагов, фибробластов, лейкоцитов и гладких мышечных клеток) обусловлены наличием на их поверхности тканевого фактора. Колла-
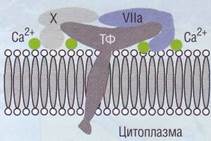
Рис. 12. Субэндотелий сосудистой стенкиорганизован полимерными белками: коллагеном, эластином и другими, Субэндотелий обладает выраженным тромбогенным эффектом, стимулируя процессы свертывания крови ген субэндотелия является субстратом для адгезии тромбоцитов. Связь коллагена с рецепторами тромбоцитов вызывает активацию последних. Помимо этого, коллаген, видимо, обладает свойством активировать белки системы контактной активации. Сосудистая стенка Тканевой фактор Тканевой фактор (ТФ) - трансмембранный белок (рис. 13), локализованный на клетках субэндотелия (фибробластах, макрофагах, гладких 18 мышечных клетках). Предположительно ТФ есть на базальной мембране эндотелиоцитов, а на апикальной мембране он может появляться после активации клеток. ТФ в норме нет на поверхности циркулирующих лейкоцитов или эритроцитов. Роль ТФ в процессе свертывания крови очень велика. При связывании фактора VIla с ТФ формируется активный комплекс, который в присутствии ионов Са2+ активирует фактор X. По современным представлениям этот процесс является основным физиологическим путем запуска процесса свертывания крови. ТФ обладает очень большой тромбогенной активностью. При патологии он выявлен на некоторых опухолевых клетках. Это является одним из факторов риска развития тромбоза при онкологических заболеваниях. Изначально ТФ классифицировали как один из плазменных факторов свертывания (тканевой тромбопластин, ф.Ш). Исследования показали, что ТФ фиксирован на клеточной мембране и в физиологических условиях не поступает в кровоток, поэтому он был исключен из классификации плазменных факторов гемостаза. ТФ присутствует практически во всех тканях, кроме сухожилий. Атеросклеротические бляшки и моноциты после стимуляции липополисахари-дами (например, клеточной мембраной бактерий)
Рис. 13. Формирование активного комплекса внешнего пути активациисвертывания на тканевом факторе, ТФ -тканевой фактор, VIIa - активный фактор VII свертывания крови (протеолитический фермент), X - неактивный фактор X свертывания крови (субстрат) или ИЛ-1 могут генерировать ТФ. После повреждения или после стимуляции клеток ТФ может экспонироваться или вновь синтезироваться. Физиологическими стимуляторами синтеза ТФ являются такие цитокины, в том числе ИЛ-1, фактор некроза опухоли (ФНО), фрагмент комплемента С5а и др. Повышение экспрессии ТФ на моноцитах обнаружено при воспалении, сепсисе, опухолях, при сердечно-сосудистой патологии, особенно у больных, перенесших инфаркт миокарда, после экстраваскулярной циркуляции крови. Имеются отдельные сообщения, что стероидные контрацептивы, принимаемые внутрь, курение вызывают повышение ТФ в системе циркуляции, что увеличивает риск тромбоза. Определение экспрессии ТФ на моноцитах проводят методом проточной цитометрии. Есть предположения, что этот метод для оценки состояния гиперкоагуляции в будущем может заменить коагулометрические методы, проводимые на цельной крови. Коллаген Коллагены - наиболее распространенные белки в организме животных. Они составляют 25% от общего количества белка. Коллагены образуют нерастворимые нити (фибриллы), которые входят в состав межклеточного матрикса и соединительных тканей. Типичная молекула коллагена состоит из трех полипептидных цепей разных типов (а-спи-ралей), скрученных в виде правой тройной спирали. В свою очередь полипептидные цепи построены из часто повторяющихся фрагментов, имеющих характерную последовательность -Gly-X-Y-. Каждым третьим аминокислотным остатком является глицин. Пролин (Pro) часто встречается в положениях X, положение Y может быть занято как пролином, так и 4-гидрокси-пролином (4Нур). Кроме того, молекула коллагена содержит остатки 3-гидроксипролина (ЗНур) и 5-гидроксилизина (5Ну1). Присутствие в полипептидной цепи остатков гидроксиаминокис-лот является характерной особенностью коллагена. Остатки пролина и лизина гидроксилиру-ются посттрансляционно, т. е. после включения в полипептидную цепь. На одном из концов молекула коллагена сшита поперечными связями, Сосудистая стенка образованными боковыми цепями остатков лизина. Количество поперечных связей возрастает по мере старения организма. Известно, по крайней мере, 12 вариантов коллагена, характеризующихся различным сочетанием полипептидных ос-цепей. Молекулы коллагенов обладают свойством спонтанно агрегировать с образованием более сложных структур, микрофибрилл и фибрилл. Большинство коллагенов образуют фибриллы цилиндрической формы(диаметром 20-500 нм) с характерными поперечными полосами, повторяющимися через каждые 64-67 нм. В гемостазе коллагены выполняют несколько важных функций: • Они образуют эластичный «каркас» сосуда и во многом определяют его прочность, устой- чивость к нагрузкам и реологические характеристики. Типы III и VI коллагена обладают высокой прокоагулянтной активностью, связывая с высокой аффинностью фактор Виллебранда, и тем самым обеспечивают адгезию тромбоцитов. Типы I и IV коллагена непосредственно взаимодействуют с тромбоцитарным рецептором GPIa-IIa, следствием чего также является адгезия тромбоцитов. Типы I, III, IV и V коллагена активируют тромбоциты, воздействуя непосредственно на тромбоцитарные рецепторы или опосредованно через фактор Виллебранда. Это влечет за собой изменение формы тромбоцитов, их адгезию и дегрануляцию.
КАФЕДРА клд ЦИКЛЫ ТЕМАТИЧЕСКОГО УСОВЕРШЕНСТВОВАНИЯ «МЕТОДЫ ИССЛЕДОВАНИЯ СИСТЕМЫ ГЕМОСТАЗА» Циклы тематического усовершенствования «Методы исследования системы гемостаза» более 20 лет систематически проводятся на кафедре клинической лабораторной диагностики Российской медицинской академии последипломного образования для заведующих и врачей клинической лабораторной диагностики. В программу циклов включены лекции по наиболее актуальным проблемам гемостаза, семинары по вопросам организации исследований гемостаза, разбору клинических случаев, интерпретации коагулограммы. На практических занятиях в малых группах осваиваются и отрабатываются лабораторные методы исследования гемостаза. К работе цикла привлекаются производители оборудования и реагентов с информацией о новейших разработках в этой области, организуются посещения ведущих лабораторий Москвы. Продолжительность циклов 2 недели, иногородним предоставляется общежитие гостиничного типа, по окончании выдаются свидетельства о повышении квалификации государственного образца. Заявки для участия в циклах усовершенствования принимаются: • по почте: 125424, Москва, а/я 32 (кафедра КЛД) • по факсу (095) 945-84-00 или телефону (095) 945-82-22 • по электронной почте: kafedra-kdl@list.ru
Тромбоциты
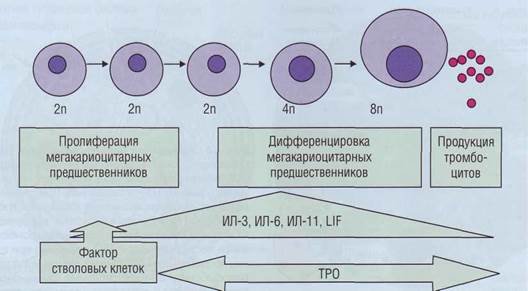
ТРОМБОЦИТЫ Тромбоцитопоэз Дифференцировка и созревание клеток мега-кариоцитопоэза происходят в костном мозге, где из коммитированных, морфологически неиденти-фицируемых клеток-предшественников (КОЕ-Мгкц) формируются колонии мегакариоцитар-ных клеточных элементов. При созревании клетки проходят три морфологически дифференцируемые стадии: мегакариобласт, который не превышает 10% всей популяции, промегакариоцит (около 15%) и мегакариоцит (рис. 14) - на его долю приходится от 75 до 85%. Процесс дифференцировки мегакариоцитар-ных элементов продолжается около 25 часов, такое же примерно время (около 25 часов) составляет созревание, а весь жизненный цикл - около 10 суток. Отличительной чертой клеточных элементов мега-кариоцитопоэза является их способность к эндоми-тозу (полиплоидизации) - делению ядра без разде-
Рис. 14. Мегакариоцит,диаметр 30-40 мкм. Ядро темно-фиолетового цвета, лопастное, с бухтообразными вдавле-ниями, фрагментированное. Хроматин распределен неравномерно, Цитоплазма обильная, содержит обильную зернистость ления цитоплазмы, что приводит к появлению гигантского размера клеток (мегакариоцитов). В процессе мегакариоцитопоэза (рис. 15) клетки проделывают от 3 до 6 эндомитозов, что соответствует плоидности мегакариоцита от 8 п до 64 п. Регуляция мегакариоцитопоэза осуществляется по принципу обратной связи: избыток тромбоцитов в крови тормозит тромбоцитопоэз, а тром-боцитопения его стимулирует. Основными регуляторами, стимулирующими мегакариоцитопоэз, являются ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-6, ИЛ-11, фактор стволовых клеток, лейкоз-ингибирующий фактор, гранулоцитарно-макрофагальный колониестиму-лирующий фактор (ГМ-КСФ), гранулоцитарный колониестимулирующий фактор (Г-КСФ), эритро-поэтин, тромбопоэтин. К факторам, ингибирую-щим тромбоцитопоэз, относят тромбоцитарный фактор 4, трансформирующий фактор роста Рр ин-терфероны-а и -у и другие ингибиторы. В а-гранулах мегакариоцитов содержится значительное количество белков: фактор Вилле-бранда, тромбоцитарный фактор 4, тромбоспон-дин, фибриноген, фибронектин, тромбоцитарный ростовой фактор, трансформирующие ростовые факторы, тромбоцитарный ингибитор коллагена-зы. Основная масса их синтезируется в мегакарио-цитах, некоторые белки, такие, как альбумин, фибриноген, IgG, поступают в клетку путем эн-доцитоза. Способность зрелых мегакариоцитов к эндоцитозу проявляется в явлении эмпириопо-лезиса, суть которого заключается в захвате ге-мопоэтических клеток. Частота его возрастает при злокачественных новообразованиях. Тромбо-цитарная пероксидаза присутствует на всех стадиях созревания клеток мегакариоцитарной линии, включая тромбоциты. Мегакариоциты, синтезируя трансформирующий ростовой фактор (3, Тромбоциты
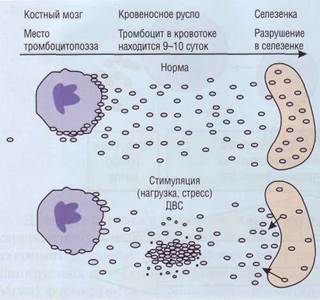
Рис. 15. Схема регуляции мегакариоцитопоэза.Внизу рисунка показаны периоды стимулирующего действия на мега-кариоцитоз основных стимуляторов. LIF - лейкоз-ингибирующий фактор, ТРО - тромбопоэтин участвуют в накоплении коллагена и развитии фиброза. Основная функция мегакариоцитопоэза -репопуляция тромбоцитов, поддержание их количества в кровотоке на постоянном уровне. Мегакариоциты располагаются в костном мозге вблизи костно-мозговых синусов и по мере созревания внутрь клетки врастают раздели- тельные мембраны, по которым в дальнейшем происходит деление цитоплазмы на тромбоциты. Существует точка зрения, что цитоплазма-тические отростки мегакариоцита (в виде лент диаметром 2-4 мкм) через миграционные поры проникают в синусы костного мозга, где и происходит отшнуровка тромбоцитов (тромбоци-тообразование). Жизненный цикл тромбоцитов Около 1/3 всей массы тромбоцитов находится в селезенке (селезеночный пул): при спленомегалии этот пул возрастает, что может приводить к перераспределительной тромбоцитопении. При стимуляции адренорецепторов (физическая нагрузка, стресс) происходит выброс тромбоцитов в циркуляцию, что приводит к кратковременному тромбо-цитозу (рис. 16). После спленэктомии также в течение некоторого времени наблюдается тромбоцитоз, который иногда достигает очень больших величин (до 800-1200 х 107л). Остальные 2/3 тромбоцитов циркулируют в крови. Средняя продолжительность жизни тромбоцитов составляет 9-10 суток. Референтные значения. У здорового человека количество тромбоцитов может несколько менять- ся в течение суток. Нормальное содержание тромбоцитов в крови колеблется в пределах 150-320 х 109/л. (В последнее время в связи с поступлением на отечественный рынок зарубежных гематологических счетчиков и анализаторов, в инструкции к которым даются зарубежные нормы, стали приводить значения нормального содержания тромбоцитов в диапазоне от 150 до 450 х 109/л.) При отсутствии в крови гемопоэтических стимулов общий объем циркулирующих тромбоцитов довольно постоянен. В патологических условиях количество и объем тромбоцитов могут меняться (рис. 17). При снижении продукции тромбоцитов гемостатический потенциал может быть частично компенсирован за счет Тромбоциты
Рис. 16. Жизненный цикл тромбоцитов.Тромбоциты образуются в костном мозге из мегакариоцитов, примерно 2/3 периферического пула находится постоянно в системе циркуляции, 1/3 - в селезенке. При стимуляции адрено-рецепторов может возникнуть временный тромбоцитоз из-за выброса тромбоцитов в систему циркуляции из костного мозга и селезенки, Опустошение тромбоцитов в селезенке происходит и при ДВС-синдроме при тромбоцитопе-нии потребления, в последнем случае могут появляться макротромбоциты с недостаточными функциональными свойствами адгезии и агрегации - возникает тромбоцитопатия
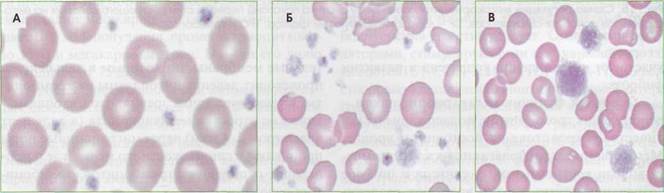
Рис. 17. Тромбоциты в периферической крови: А- нормальные тромбоциты, Б - анизоцитоз тромбоцитов при хроническом моноцитарном лейкозе (нарушение дифференцировки на уровне полипотентных коммитированных предшественников мегакариоцитопоэза), В - гигантские тромбоциты (макротромбоциты) при аутоиммунной тромбоцитопении повышения их объема. В обратной ситуации, при повышении количества тромбоцитов выше 450 х 109/л, объем тромбоцитов не снижается ниже определенного физиологического уровня. Соответственно общий объем тромбоцитарного пула в крови возрастает пропорционально увеличению количества тромбоцитов. Это может приводить к увеличению тромбогенного потенциала. С помощью автоматических гематологических анализаторов можно измерить средний объем тромбоцитов (MPV), дисперсию распределения тромбоцитов по объему (RDW) и оценить гистограмму распределения тромбоцитов по объему. Структура тромбоцитов Тромбоцит - безъядерная сферическая клетка диаметром 2-4 мкм, средний объем 7,5 мкм3 (от 3 до 10 мкм3, или фл-фемтолитры). Микроформы тромбоцитов имеют диаметр менее 1,5 мкм, макроформы могут достигать 6-10 мкм. Интакт-ные тромбоциты имеют форму диска или пластины диаметром 2,8-3,4 мкм, толщиной 0,8-1,2 мкм и объемом от 5,7 до 8,9 мкм3 (рис. 18). В циркули- Тромбоцит
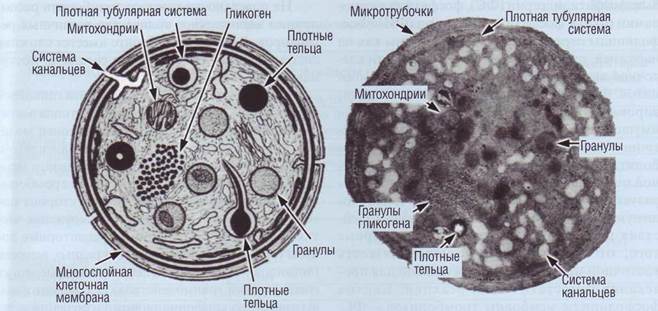
Рис. 18. Тромбоцит (рисунок и микрофотография).Интактные тромбоциты имеют форму диска, В цитоплазме расположены митохондрии, пероксисомы (содержат каталазу), включения гликогена, лизосомы и гранулы, содержащие пулы хранения различных веществ рующем пуле преобладают зрелые пластинки ди- ляют 1-10%, а «старые» - микротромбоциты ме-аметром 2-3 мкм (80-95%), «молодые» формы - нее 2 мкм - 3-15%. макротромбоциты размером свыше 3 мкм - состав- Мембрана и цитоскелет тромбоцитов Структура поверхностной мембраны тромбоцита сложна. Наружная поверхность тромбоцита покрыта гликокаликсом, богатым глико-протеинами. В пространствах многослойной мембраны расположены микротрубочки, формирующие цитоскелет тромбоцита. Цитоплазмати-ческая мембрана тромбоцитов внедряется внутрь клетки с образованием многочисленных переплетенных канальцев, связанных с внеклеточным пространством. Эта система называется «связанной с поверхностью канальцевой системой», или «открытой канальцевой системой» (ОКС). Обнаружено, что на поверхности мембраны ОКС имеются те же гликопротеиды, что и на внешней мембране тромбоцитов. Таким образом, ОКС значительно увеличивает активную тромбоцитарную поверхность, что важно при изменении формы тромбоцита во время его активации. Непосредственно в подмембранном пространстве расположены плотные микротрубочки, образующие особую плотную микротубуляр-ную систему (ПМТС), не связанную с внеклеточным пространством. ПМТС развивается из ме-гакариоцитарного эндоплазматического ретику-лума. Эта система является местом депонирования кальция и синтеза простагландинов. Кроме того, образуя концентрические субмембранные структуры, ПМТС является частью цитоскелета тромбоцитов. Важное свойство мембраны интактных тромбоцитов - это разный фосфолипидный состав наружной и внутренней поверхности. Основные фосфолипиды, входящие в состав тромбоцитов, можно разделить на 2 группы: 1) не обладающие прокоагулянтной активностью холиновые: фос-фатидилхолин (ФХ) и сфингомиелин (СФ), 2) обладающие прокоагулянтными свойствами кис- Тромбоциты
лые: фосфатидилсерин (ФС), фосфатидилэтано-ламин (ФЭ) и фосфатидилинозитол (ФИ). Фос-фолипиды первой группы распределены как на наружней, так и на внутренней поверхности клеточной мембраны неактивированных тромбоцитов. Фосфолипиды второй группы в неактивированных тромбоцитах локализованы преимущественно на внутренней поверхности клеточной мембраны. В процессе активации тромбоцита концентрация ФС, ФЭ и ФИ на наружной поверхности значительно возрастает и образует прокоагулянтную поверхность, необходимую для фиксации, активации и взаимодействия плазменных белков гемостаза. Кроме того, это перераспределение меняет вязкость клеточной мембраны, что тоже важно для протекания гемостатических реакций. Кислые фосфолипиды мембраны тромбоцитов - ФС, ФИ и ФЭ называют фактором 3 тромбоцитов (ф.З, PF3), или тромбоцитарным тромбоплас-тином. Помимо ПМТС, цитоскелет тромбоцитов образуют нити актина, спектрина и других протеинов, связанные с мембраной и пронизывающие тромбоцит во всех направлениях. Функциями белков цитоскелета тромбоцитов являются: • поддержание формы интактных тромбоци • изменение формы при активации тромбоци • «фиксация» плазматической части трансмем • передача сигнала от внутренних структур к • участие в «направленном» внутритромбоци- • передача внутриклеточных сигналов.
Поиск по сайту: |