|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Механизм действия ферментов
Акт катализа складывается из трех последовательных этапов.
1. Образование фермент-субстратного комплекса при взаимодействии через активный центр.
2. Связывание субстрата происходит в нескольких точках активного центра, что приводит к изменению структуры субстрата, его деформации за счет изменения энергии связей в молекуле. Это вторая стадия и называется она активацией субстрата. При этом происходит определенная химическая модификация субстрата и превращение его в новый продукт или продукты.
3. В результате такого превращения новое вещество (продукт) утрачивает способность удерживаться в активном центре фермента и фермент-субстратный, вернее уже фермент-продуктный комплекс диссоциирует (распадается).
Виды каталитических реакций:
А+Е = АЕ = БЕ = Е + Б А+Б +Е = АЕ+Б = АБЕ = АБ + Е АБ+Е = АБЕ = А+Б+Е, где Е - энзим, А и Б - субстраты, либо продукты реакции.
Ферментативные эффекторы - вещества, изменяющие скорость ферментативного катализа и регулирующие за счет этого метаболизм. Среди них различают ингибиторы - замедляющие скорость реакции и активаторы - ускоряющие ферментативную реакцию.
В зависимости от механизма торможения реакции различают конкурентные и неконкурентные ингибиторы. Строение молекулы конкурентного ингибитора сходно со структурой субстрата и совпадает с поверхностью активного центра как ключ с замком (или почти совпадает). Степень этого сходства может даже быть выше чем с субстратом.
Если А+Е = АЕ = БЕ = Е + Б , то И+Е = ИЕ ¹
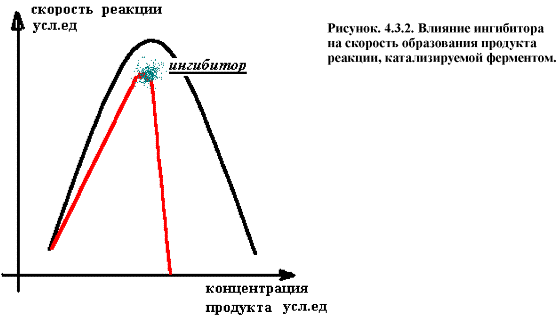
Концентрация способного к катализу фермента при этом снижается и скорость образование продуктов реакции резко падает (рис. 4.3.2.).
В качестве конкурентных ингибиторов выступает большое число химических веществ эндогенного и экзогенного происхождения (т.е. образующихся в организме и поступающих извне – ксенобиотики, соответственно). Эндогенные вещества являются регуляторами метаболизма и называются антиметаболитами. Многие из них используют при лечении онкологических и микробных заболеваний, тк. они ингибируют ключевые метаболичекие реакции микроорганизмов (сульфаниламиды) и опухолевых клеток. Но при избытке субстрата и малой концентрации конкурентного ингибитора его действие отменяется.
Второй вид ингибиторов - неконкурентные. Они взаимодействую с ферментом вне активного центра и избыток субстрата не влияет на их ингибирующую способность, как в случае с конкурентными ингибиторами. Эти ингибиторы взаимодействуют или с определенными группами фермента (тяжелые металлы связываются с тиоловыми группами Цис) или чаще всего регуляторным центром, что снижает связывающую способность активного центра. Собственно процесс ингибирования - это полное или частичное подавление активности фермента при сохранении его первичной и пространственной структуры.
Различают также обратимое и необратимое ингибирование. Необратимые ингибиторы инактивируют фермент, образуя с его АК или другими компонентами структуры химическую связь. Обычно это ковалентная связь с одним из участков активного центра. Такой комплекс практически недиссоциирует в физиологических условиях. В другом случае ингибитор нарушает конформационную структуру молекулы фермента - вызывает его денатурацию.
Действие обратимых ингибиторов может быть снято при переизбытке субстрата или под действием веществ, изменяющих химическую структуру ингибитора. Конкурентные и неконкурентные ингибиторы относятся в большинстве случаев к обратимым.
Помимо ингибиторов известны еще активаторы ферментативного катализа. Они: 1) защищают молекулу фермента от инактивирующих воздействий, 2) образуют с субстратом комплекс, который более активно связывается с активным центром Ф, 3) взаимодействуя с ферментом, имеющим четвертичную структуру, разъединяют его субъединицы и тем самым открывают доступ субстрату к активному центру.
Поиск по сайту: |