10.2.1.Основная масса аминокислот, образовавшихся в пищеварительном тракте в результате переваривания белков, всасывается в кровь и пополняет аминокислотный фонд организма. Определённое количество невсосавшихся аминокислот подвергается гниению в толстом кишечнике.
Гниение – превращения аминокислот, вызванные деятельностью микроорганизмов в толстом кишечнике. Усилению процессов гниения аминокислот могут способствовать:
· избыточное поступление белков с пищей;
· врождённые и приобретённые нарушения процесса всасывания аминокислот в кишечнике;
· снижение моторной функции кишечника.
В результате гниения аминокислот образуются различные вещества, многие из которых являются токсичными для организма. Некоторые примеры продуктов гниения приводятся в таблице 10.2.
Таблица 10.2 Продукты гниения аминокислот в кишечнике.
| Аминокислоты
| Продукты гниения
| | Тирозин
| Крезол
| | | Фенол
| | | Триптофан
| Скатол
| | | Индол
| | | Цистеин, Метионин
| Метилмеркаптан
| | | Сероводород
| | | Лизин
| Кадаверин
| | | Орнитин
| Путресцин
| | 10.2.2. Продукты гниения аминокислот являются ксенобиотиками – веществами, чужеродными для организма человека и должны быть обезврежены (инактивированы).
Обезвреживание продуктов гниения аминокислот происходит в клетках печени после поступления веществ из кишечника с кровью воротной вены. Продукты обезвреживания хорошо растворяются в воде и поэтому легко выводятся из организма. Процесс обезвреживания включает, как правило, две фазы (стадии): фазу модификации и фазу конъюгации.
10.2.3. В фазе модификации вещества вступают в реакции микросомального окисления, в результате которого образуются полярные группы —ОН или —СООН. Если такие группы уже имеются, то обезвреживание может происходить непосредственно путём конъюгации.
Реакции конъюгации заключаются в том, что к указанным группам присоединяется определённое соединение (глюкуроновая кислота, серная кислота, глицин и некоторые другие). Активной формой глюкуроновой кислоты является уридиндифосфоглюкуроновая кислота (УДФГК), активной формой серной кислоты - 3'-фосфоаденозин-5'-фосфосульфат (ФАФС). Формулы этих соединений приводятся на рисунке 10.2.
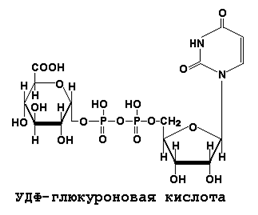
Рисунок 10.2. Активные формы глюкуроновой и серной кислот.
10.2.4.Запомните некоторые примеры реакций обезвреживания:
1) обезвреживание фенола (реакция глюкуронидной конъюгации):

2) обезвреживание индола:
а) гидроксилирование индола (фаза модификации):

б) сульфатирование индоксила (фаза конъюгации):

в) образование калиевой соли индоксилсульфата в канальцах почек:

По количеству индикана в моче можно сделать заключение о скорость процессов гниения белков в кишечнике (при усилении гниения количество индикана увеличивается) и о функциональном состоянии печени (при нарушении обезвреживающей функции количество индикана уменьшается).
3) обезвреживание бензойной кислоты:

По скорости образования и выведения гиппуровой кислоты с мочой после введения бензойной кислоты можно судить о функциональном состоянии печени. Этот диагностический тест получил название пробы Квика и используется в клинической практике.
| 
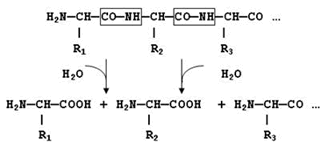 Рисунок 10.1. Гидролиз пептидных связей.
10.1.2.Все протеолитические ферменты можно разделить на две группы:
1. экзопептидазы – катализируют разрыв концевой пептидной связи с освобождением N- или С-концевой аминокислоты;
2. эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи, продуктами реакции являются пептиды с меньшей молекулярной массой.
10.1.3.Большинство протеолитических ферментов, участвующих в переваривании белков и пептидов, синтезируются и выделяются в полость пищеварительного тракта в виде неактивных предшественников – проферментов (зимогенов). Поэтому не происходит переваривания белков клеток, вырабатывающих проферменты. Активация проферментов осуществляется в просвете желудочно-кишечного тракта путём частичного протеолиза – отщепления части пептидной цепи зимогена.
10.1.4.Характеристика важнейших протеолитических ферментов приводится в таблице 10.1.
Таблица 10.1 Некоторые протеолитические ферменты желудочно-кишечного тракта.
Рисунок 10.1. Гидролиз пептидных связей.
10.1.2.Все протеолитические ферменты можно разделить на две группы:
1. экзопептидазы – катализируют разрыв концевой пептидной связи с освобождением N- или С-концевой аминокислоты;
2. эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи, продуктами реакции являются пептиды с меньшей молекулярной массой.
10.1.3.Большинство протеолитических ферментов, участвующих в переваривании белков и пептидов, синтезируются и выделяются в полость пищеварительного тракта в виде неактивных предшественников – проферментов (зимогенов). Поэтому не происходит переваривания белков клеток, вырабатывающих проферменты. Активация проферментов осуществляется в просвете желудочно-кишечного тракта путём частичного протеолиза – отщепления части пептидной цепи зимогена.
10.1.4.Характеристика важнейших протеолитических ферментов приводится в таблице 10.1.
Таблица 10.1 Некоторые протеолитические ферменты желудочно-кишечного тракта.





