 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Самовоспламенение. Стационарная теория
Стационарная теория самовоспламенения (теория теплового взрыва) объясняет наличие критических условий самовоспламенения. В этой теории рассматривается стационарное в тепловом отношении состоящие реагирующей системы «горючее вещество - окислитель», при котором теплоотвод от системы равен тепловыделению. Теория позволяет определить условия достижения критического состояния. При этом для решения задачи используется модель реакции нулевого порядка, характеризующаяся отсутствием расходования в процессе реагирования исходных продуктов. Тепловая теория самовоспламенения разработана академиком Н. Н. Семеновым. Она заключается в следующем. Предположим, в сосуде объемом V находится горючая смесь. Температура стенок сосуда поддерживается постоянной и равна То. При температуре смеси Т в ней будет протекать химическая реакция со скоростью со, подчиняющаяся закону Аррениуса: ω = K0 *C n где С - концентрация кислорода, n - порядок реакции, R - универсальная газовая постоянная, Е - энергия активации. При величине теплового эффекта реакции равным q скорость выделения тепла q1 реагирующей со смесью составит:
Часть выделившегося тепла пойдет на нагревание смеси, а остальное тепло будет отводиться в окружающую среду. Количество отводимого тепла q2 равно:
где α - коэффициент теплоотвода, S - поверхность стенок сосуда, в котором заключена смесь. Для выяснения условий самовоспламенения рассмотрим рис 3.1. Па этом графике по горизонтальной оси отложена температура смеси, а по вертикальной - количество тепла, выделяющегося и отводимого в единицу времени. Три наклонных прямых q2 (Т) соответствуют трем значениям начальной температуры.
При установившемся состоянии реагирующей смеси тепловыделение от реакции q1 будет равно теплоотводу q2. Соответствующая этому тоянию температура будет равна абсциссе точек пересечения кривых q1 (Т) и q2 (Т) Из рис. 3.1 видно, что кривые тепловыделения и теплоотвода иногда пересекаются в двух точках, а иногда - в одной. Рассмотрим первый случай - пересечение в двух точках. Смесь с начальной температурой То за счет теплоты реакции будет нагреваться до равновесного состояния, отображаемого точкой С (при этом температура реагирующей смеси равна Та). Это состояние системы будет устойчивым, поскольку дальнейшее повышение температуры сопровождается превышением теплоотвода над тепловыделением. Вторая точка пересечения кривых В лежит в области более высоких температур и тепловой режим системы в этом случае будет неустойчивым. При отклонении от состояния, отвечающего точке В, система в прежнее состояние уже не возвратится, а будет все более отклоняться от него. При увеличении начальной температуры стенок сосуда То прямая, характеризующая теплоотвод, будет смещаться вправо, а температура реагирующей смеси Та будет непрерывно и плавно возрастать. При некоторой температуре Тсв кривые q1 (Т) и q2 (Т) соприкасаются (точка С), что физически означает равенство при этой температуре величин тепловыделения и теплоотвода. Точка С характеризует граничные условия существования стационарного режима. При незначительном повышении температуры стенки сосуда по сравнению с Тсв тепловыделение будет превышать теплоотвод и произойдет резкое увеличение температуры реагирующей смеси. Явление, заключающееся в переходе от медленно протекающей реакции, сопровождающейся незначительным разогревом, к бурному прогрессивно ускоряющемуся выгоранию смеси, называется самовоспламенением. В научной литературе его часто называют явлением «теплового взрыва». Рассмотрим количественные соотношения, характеризующие процесс самовоспламенения газовых смесей. В точке касания кривых тепловыделения и теплоотвода величины q1 и q2 , а также их производные по температуре равны. Таким образом, для критического условия существования смеси можно записать:
Разделив левые и правые части уравнений, получим:
или
Отсюда
Температуре самовоспламенения в формуле (3.8) соответствует знак минус перед значением квадратного корня. Установлено, что Т0 << формуле (3.8) можно заменить разложением в ряд и с достаточной точностью ограничиться тремя первыми членами разложения. Тогда получаем:
И окончательно:
Многочисленными экспериментами установлено, что величина
С учетом этого, формула (3.5) может быть представлена в виде:
Соотношение (3.11) устанавливает связь, между составом горючей и величиной температуры самовоспламенения. Если принять порядок реакции n = 2, то зависимость между С и Тсв отражается кривой, показанной на рис. 3.2 и ограничивающей область самовоспламеняющихся смесей.
Теория, в полном согласии с экспериментом, показывает, что не любая смесь горючего с окислителем может самовоспламениться. Самовоспламеняются лишь смеси, состав которых находится в пределах соответствующих концентраций. В настоящее время установлено, что при самовоспламенении могут преобладать тепловые, либо цепные процессы. При дальнейшем изложении мы ограничимся рассмотрением вопросов, относящихся к тепловой теории. Величина температуры самовоспламенения зависит от химического строения веществ и находится в области достаточно высоких температур: Вещество Температура самовоспламенения, °С Метан 535 Этан 515 Пропан 465 Бутан 405 Пентан 285 Гексан 235 Этилен 540 Аммиак 650 Бензол 535 Сероуглерод 105 Детонация. Детонацией называется процесс превращения горючей смеси или взрывчатого вещества ВВ, сопровождающийся выделением теплоты и распространяющийся с постоянной скоростью, превышающей скорость распространения звука в данной смеси или веществе. В отличие от дефлаграционного горения, где распространение пламени обусловлено относительно медленными процессами диффузии и теплопроводности, детонация представляет собой комплекс мощной ударной волны и следующей за ее фронтом зоны химического превращения. Благодаря резкому повышению температуры и давления за фронтом ударной волны химическое превращение исходных веществ в продукты горения протекает чрезвычайно быстро в очень тонком слое, непосредственно прилегающем к фронту ударной волны (рис. 4.3)
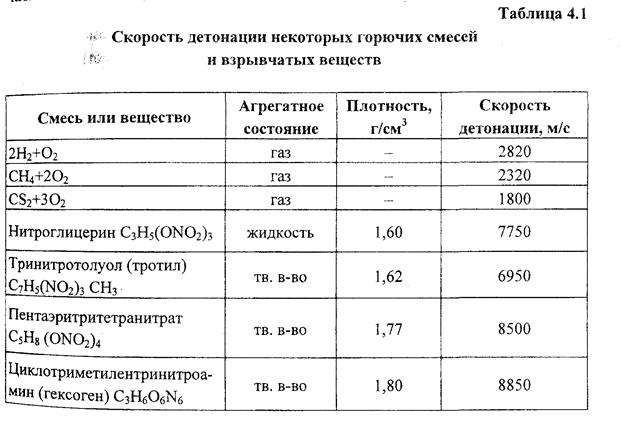
Ударная волна сжимает и нагревает горючую смесь (или взрывчатое вещество), вызывая химическую реакцию, продукты которой сильно расширяются - происходит взрыв. Энергия, выделяющаяся в результате химического превращения, поддерживает существование ударной волны, не давая ей затухать. Скорость перемещения детонационной волны постоянна для каждой горючей смеси и взрывчатого вещества и достигает 1000-3000 м/с в газовых смесях и 8000-9000 м/с - в конденсированных взрывчатых веществах (табл. 4.1).
Давление во фронте ударной волны при детонации газовых смесей достигает 1-5 МПа (10-50 атм), конденсированных веществ - 10 ГПа (105 атм). Детонация взрывчатых веществ может инициироваться интенсивным механическим или тепловым воздействием (удар, искровой разряд, взрыв металлической проволочки под действием электрического тока и т.д.). Сила воздействия, необходимая для возбуждения детонации зависит от химической природы взрывчатого вещества или состояния горючей газовой смеси. К механическому воздействию чувствительны, так называемые инициирующие взрывчатые вещества (гремучая ртуть, азид свинца и др.), которые обычно входят в состав капсюлейдетонаторов, используемых для возбуждения детонации вторичных (менее чувствительных) взрывчатых веществ. В конденсированном взрывчатом веществе детонация распространяется с постоянной скоростью, которая среди возможных для этого вещества скоростей распространения детонационной волны является минимальной. При этом зона химического превращения перемещается относительно исходного вещества со сверхзвуковой скоростью. Вследствие этого волны разрежения, возникающие при расширении газообразных продуктов химической реакции, не могут проникнуть в зону реакции и ослабить распространяющуюся впереди ударную волну. Детонация, отвечающая описанным выше условиям, называется процессом Чепмена-Жуге. Соответствующая ей минимальная скорость распространения детонационной волны принимается в качестве характеристики взрывчатого вещества или горючей смеси. Современная теория детонации позволяет рассчитывать значения ее скорости и распределение давления, плотности и температуры в детонационной волне относительно продуктов реакции и скорости звука в них. Взаимосвязь давления и объема в распространяющейся ударной детонационной волне показана на рис. 4.4, на котором адиабата АВ соответствует ударной волне, распространяющейся в газовой смеси (р — давление, V - объем) и не вызывающей химической реакции. СД - адиабата, построенная в предположении, что химическая реакция завершилась. При детонации вначале происходит ударный переход 1—2 (адабатический процесс), затем химическая реакция переводит вещество из состояния 2 в состояние 3 по прямой, касающейся адиабаты СД. Дальнейшее расширение вещества идет по адиабате СД. Скорость газовой детонации Vдет рассчитывается по формуле: Vдет = где q - тепловой эффект реакции, ν - показатель диабаты.
При определенных условиях в горючей смеси может быть возбуждена детонация, скорость распространения которой превышает минимальную скорость детонации. Например, взрыв заряда твердого взрывчатого вещества, помещенного в горючую газовую смесь, вызывает в ней ударную волну, интенсивность которой во много раз превосходит интенсивность волны, соответствующей режиму с минимальной скоростью. В результате в газовой смеси распространяется детонационная волна с повышенной скоростью. В газообразных горючих смесях распространение детонации возможно только при условиях, когда концентрация горючего газа (или паров горючей жидкости) находится в определенных пределах, зависящих от химической природы горючей смеси, давления и температуры. Например, в смеси водорода с кислородом при комнатной температуре и атмосферном давлении детонационная волна способна распространяться, если концентрация водорода находится в пределах от 20 до 90% об. Переход дефлаграционного горения в детонацию. Переход дефлаграционного горения в детонацию в газовоздушных смесях возможен в следующих случаях: • при обогащении горючей смеси кислородом; • при очень больших размерах газовых облаков; • при наличии турбулизаторов горения. Согласно теории гидродинамической неустойчивости и автотурбу-лизации фронта нормального горения в горючих облаках достаточно больших размеров неизбежен переход от дефлаграционного горения к детонации. Экстраполяционные оценки приводят к следующим критическим размерам облаков, при которых вероятность возникновения детонации высока: для водородовоздушных смесей - 70 м, для пропановоздушных - 3500 м, для метановоздушных - 5000 м. Турбулизация процесса горения газовых смесей с помощью различых препятствий по пути распространяющегося пламени приводит к существенному сокращению критических размеров газовых облаков, и возникающая в этом случае детонационная волна становится источником возбуждения детонации в неограниченном пространстве. Проф. В. И. Макеевым экспериментально изучена возможность перехода дефлаграции в детонацию при горении смесей СН4 + 2(О2 + βN2,) и 2H2 +O2 +βN2 при значениях β в интервале от 0 до 3,76 в объеме 6 м3 с частично загроможденным пространством. Для загромождения использовались в различных комбинациях три тонкостенные металлические концентрически расположенные сферы-турбулизатора с большим количеством отверстий. Коэффициент проницаемости сфер составлял от 0,1 до 0,4, соотношение диаметров 1:2:4. Отношение объема, занятого турбулизатором к объему горючей смеси составляло от 0,01 до 0,48%. Горение инициировалось в центре сфер пережигаемой нихромовой проволочкой. Переход от дефлаграции к детонации наблюдался в смесях смесей СН4 + 2(О2 + βN2,) при β < 1 и в смесях 2H2 +O2 +βN2, при β ≤ 3,2. С учетом полученных данных можно полагать, что для воздушных смесей (β = 3,76) водорода и метана критический размер загроможденного пространства, при котором возможен переход к детонации, составляет примерно 1 и 10 м соответственно. Зависимости критической энергии возбуждения детонации в загроможденном пространстве для исследованных смесей от состава смеси показаны на рис. 4.5 и 4.6.
Расчет параметров детонационных волн в смесях водород-кйслород-инертный газ.* Детонационные волны, образующиеся при сгорании газовых смесей, характеризуются следующими параметрами: скоростью детонации, температурой и давлением в детонационной волне. Для определения этих параметров проф. Ю. Н. Шебеко с сотр. предложен метод расчета, основанный на рассмотрении химической реакции вида:
В диапазоне температур примерно до 5500 К другие компоненты в продуктах реакции не образуются в существенных количествах. Введем константу п, равную числу всех атомов, участвующих в химической реакции; в ходе реакции эта величина остается неизменной. Для n имеем соотношение
Обозначим общее число молей вещества, участвующего в химической реакции в точке равновесия, через Введем мольную долю каждого компонента доли» всех атомов Полная система уравнений для расчета детонационных адиабат содержит четыре уравнения материального баланса по атомам (4.13)-(4.16); четыре уравнения химического равновесия (4.17)-(4.21); уравнение состояния (4.22); и три уравнения газодинамики; уравнение непрерывности (4.23), и два уравнения, являющиеся следствием закона сохранения плотности потока-импульса (4.24) и энергии (4.25). Уравнения материального баланса по атомам (кислород) 2у1 + у3 + y4 + у5 = c1у0; (4.13) (водород) 2у2 + у3 + 2у4 + у6 = с2у0; (4.14) (аргон) у7 = с3уо; (4.15) у1 + у2 + y3 + у4 +у5 + у6 + c3у0 =1 (4.16) Уравнения химического равновесия
Уравнение состояния:
Уравнение неразрывности:
Уравнение сохранения потока импульса:
Уравнение сохранения энергии:
Таким образом, система содержит 12 уравнений при 13 неизвестных (уо-у7) Р, р, Т,µ0,u.Чтобы замкнуть систему, необходимо дополнительное уравнение, называемое условием Чемпена-Жуге: равенство скорости газа u в системе волны и местной скорости звука аf
где γf определяется равенством γf = Система уравнений (4.13-4.24) позволяет сократить число переменных, выразив Состояния Ченмена-Жуге рассматриваются для начальной температуры 298,15 К при начальных давлениях до 0,25 МПа. В табл. 4.1. представлены результаты расчетов; параметры состояния Чепмена-Жуге для двенадцати составов исходной смеси, при стандартных начальных условиях (начальное давление равно 1 атм, температура 298,15 К). В табл. 4.2. представлены рассчитанные значения температуры, давления и скорости детонации для некоторых смесей. В третьей колонке этой таблицы даны экспериментально измеренные значения скорости детонации. Рис. 4.7 иллюстрирует хорошее согласие расчетных значений с экспериментом для водородокислородной смеси в широком диапазоне концентраций водорода, а рис. 4.8 - для гремучей смеси, разбавленной аргоном. Существенное возрастание скорости детонации, при превышении процентного содержания водорода в смеси стехиометрической отметки (67 %) объясняется уменьшением средней молярной массы смеси. Скорость фронта детонации зависит от удельного энерговыделения по закону
Графики зависимости температуры и давления в точке ЧЖ от содержания водорода в кислородоводородной смеси {рис. 4.9 и 4.10) имеют максимум при 67% Н2 (гремучая смесь). Эта точка отвечает максимальному молярному энерговыделению. Зависимость температуры от давления (рис.4.11) почти линейна, что, согласно уравнению состояния (4.21), говорит о постоянстве молярного объема в точке ЧЖ для рассмотренных концентраций водорода в смесях при одинаковых начальных условиях. Параметр γ, равный отношению теплоемкостей существенно меняется при изменении состава исходной смеси. На рис. 4.12 изображен график зависимости γ от процентного содержания водорода в исходной смеси с кислородом. Резкое уменьшение значения γ в диапазоне начальных концентраций от 6 до 38 процентов объясняется существенным увеличением в сгоревшей смеси содержания паров воды, но при дальнейшем увеличении доли водорода в исходной смеси, из-за возрастания температуры продуктов сгорания, начинает сказываться диссоциация, молекул и, в результате этого, увеличивается содержание атомарного кислорода и водорода. Это приводит к тому, что γ сгоревшей смеси перестает уменьшаться, и график, изображающий зависимость у от содержания водорода в исходной смеси (рис. 4.12), имеет небольшой максимум. Зависимость мольных долей молекул разного вида (отличающихся числом степеней свободы) от содержания водорода в исходной смеси изображена на рис. 4.13.
На рис. 4.14 представлены графики, изображающие зависимость скорости детонации и скорости звука в точке ЧЖ для смеси, состоящей из двух молей водорода, одного моля кислорода и инертного разбавителя аргона). Видно, что вначале как скорость детонации, так и скорость звука в точке ЧЖ быстро убывают, затем зависимость становится более плавной, а затем, в области концентрации Н2 70-95 % опять резко убывает. Если в области концентраций аргона до 70 % уменьшение скоростей детонации и звука в точке ЧЖ объясняется уменьшением удельного энерговыделения за счет замещения части горючего и окислителя инертным аргоном, то после прохождения этой отметки резкое падение скоростей детонации и звука, а также температуры (рис. 4.15) и давления (рис. 4.16) в точке Чепмена-Жуге происходит за счет неполного сгорания.
На рис. 4.17-4.20 представлены графики, показывающие зависимость основных химических и термодинамических параметров детонационной волны в газовой смеси, состоящей из одного моля кислорода и двух молей водорода с добавкой аргона, от начального давления в диапазоне 0,05-0,25 МПа. По графикам (рис. 4.17-4.18) видно, что с ростом давления, скорость детонации и скорость звука в точке ЧЖ растут, причем скорость детонации растет примерно в два раза быстрее, чем скорость звука. Как следует из уравнения (4.23.), увеличение разности скорости детонации и скорости газа в точке Чепмена-Жуге говорит об увеличении удельного энерговыделения в детонирующей смеси. Это подтверждают рис. 4.19 и 4.20, на которых изображены зависимости мольных долей различных соединений в прореагировавшей газовой смеси. По графикам видно, что с ростом начального давления подавляется диссоциация молекул, а выгорание горючего растет. Производная от скоростей по давлению практически не меняется для смесей с разным содержанием аргона, однако и скорость детонации и скорость в точке ЧЖ убывают при возрастании содержания аргона. Давление в точке ЧЖ, с ростом начального давления растет линейно, с коэффициентом роста, уменьшающимся при увеличении содержания аргона.
Взрывы пылей Пыли являются разновидностью аэрозолей - дисперсных систем, состоящих из мелких частиц, взвешенных в воздухе. К пылям принято относить системы с размерами твердых частиц от 10 до 250 мкм. Особенностью пылей является их способность к оседанию под действием сил тяжести. В общем случае свойства пылей определяются природой вещества, из которого состоят частицы, свойствами газовой среды, концентрацией частиц, их размерами и формой. Взрывоопасными являются пыли различной природы: пыли металлов (пыль алюминия - одна из самых взрывоопасных пылей), угольные пыли, пыли пластмасс, лекарственных препаратов и др. Механизмы горения пылей различной природы существенно различаются. В настоящем разделе мы ограничимся рассмотрением горения пылей во взвешенном состоянии, частицы которых образованы органическими веществами. Их отличительной особенностью применительно к рассматриваемому процессу является низкая (по сравнению с температурой пламени) температура кипения или разложения. К числу основных особенностей двухфазных систем, определяющих специфику их горения, относятся: • неоднородность взвеси из-за дискретного распределения в пространстве твердых частиц; • неизотропность взвеси из-за возможности относительного движения твердой и газовой фаз; • турбулентность и нестационарность пылевоздушной смеси, как следствие условий образования и оседания. Несмотря на существенное различие физических явлений, имеющих при горении гомогенных и аэродисперсных систем, между этими процессами имеется и много общего, в том числе - внешнее сходство пламен, движущихся по горючей среде. С учетом особенностей горения пылевоздушных смесей в данном разделе приняты следующие обозначения физических величин, характеризующих состояние рассматриваемых в моделях аэродисперсных систем. Символами w,u,p,ρ обозначены: векторная скорость фазы, ее составляющая по осям X и У, плотность фазы на единицу объема аэровзвеси, давление газовой фазы; % и V - соответственно температуропроводность и кинематическая вязкость газовой фазы; индексами 1, 2,1, 5* и отмечены величины, относящиеся соответственно к воздуху, продуктам горения, фронту пламени и конденсированной фазе (частицам). ds,ps - соответственно диаметр (предполагается сферическая форма пылинок) и плотность частиц пыли. Под фронтом пламени в аэровзвеси понимается область значительных градиентов физических параметров, характеризующих горящую аэродисперсную систему (зону предпламенного разогрева, зону химических превращений и зону релаксации мелкомасштабных - по длине порядка расстояний между частицами - неоднородностей параметров).
Поиск по сайту: |
 (3.1)
(3.1) (3.2)
(3.2) (3.З)
(3.З)
 (3.4)
(3.4) (3.5)
(3.5) (3.6)
(3.6) (3.7)
(3.7) (3.8)
(3.8) . Поэтому подкоренное выражение в
. Поэтому подкоренное выражение в (3.9)
(3.9) (3.10)
(3.10) не превышает нескольких процентов от значения То. Поэтому, не делая заметной ошибки, можно принять:
не превышает нескольких процентов от значения То. Поэтому, не делая заметной ошибки, можно принять:
 (3.11)
(3.11)

 (4.12)
(4.12)



 начальное число молей
начальное число молей 
 и «мольные
и «мольные ,
, 
 (4.17)
(4.17) (4.18)
(4.18) (4.19)
(4.19) (4.20)
(4.20) ;
;  (4.21)
(4.21) (4.22)
(4.22) (4.23)
(4.23) (4.24)
(4.24) (4.25)
(4.25) .
. через y0 и y5-y7 а остальные переменные представив в безразмерном виде.
через y0 и y5-y7 а остальные переменные представив в безразмерном виде. где Q удельная энтальпия сгорания смеси, и, кроме того, от скорости звука в исходной смеси. Поэтому, даже когда молярное энерговыделение падает, скоpость детонации растет за счет уменьшения молярной массы и увеличения скорости звука. Согласие экспериментальных и расчетных значений для смесей, содержащих инертный разбавитель (аргон), несколько хуже. График зависимости скорости детонации от содержания аргона в смеси, состоящей из двух молей водорода и одного моля кислорода представлен на рис. 4.9. Там же отмечены точки, соответствующие экспериментально измеренной скорости детонации.
где Q удельная энтальпия сгорания смеси, и, кроме того, от скорости звука в исходной смеси. Поэтому, даже когда молярное энерговыделение падает, скоpость детонации растет за счет уменьшения молярной массы и увеличения скорости звука. Согласие экспериментальных и расчетных значений для смесей, содержащих инертный разбавитель (аргон), несколько хуже. График зависимости скорости детонации от содержания аргона в смеси, состоящей из двух молей водорода и одного моля кислорода представлен на рис. 4.9. Там же отмечены точки, соответствующие экспериментально измеренной скорости детонации.