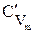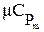|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ОПРЕДЕЛЕНИЕ ТЕПОЁМКОСТИ ВОЗДУХА ⇐ ПредыдущаяСтр 7 из 7
Цель работы: углубление знаний теплоёмкости тела, ознакомление с методикой опытного определения теплоёмкости и получение навыков в проведении эксперимента. В результате работы должны быть усвоены понятия истинной и средней теплоёмкостей, зависимость теплоёмкости от температуры.
Задание
1. Экспериментально определить объемную среднюю изобарную теплоемкость воздуха методом прочного калориметрирования. 2. По экспериментальным данным вычислить средние массовую и молярную изобарные теплоемкости воздуха: средние массовую, объёмную и молярную изохорные теплоемкости воздуха. 3. Определить показатель адиабаты для воздуха. 4. Вычислить энтальпию и внутреннюю энергию воздуха при его температуре на выходе из калориметра. 5. Сравнить полученные данные с табличными. 6. Составить отчет по выполненной работе.
Основные понятия
Для определения количества теплоты, участвующей в любом процессе, используется понятие теплоемкости. Теплоемкостью называется количество теплоты, необходимое для изменения температуры тела в каком - либо термодинамическом процессе на 1 К (или на 1°С). Теплоемкость единицы вещества называется удельной. Различают массовую С , кДж/(кг•К); объемную
где
где Рн - давление при нормальных физических условиях, Рн = 101325 Па; Тн - температура при нормальных физических условиях, Тн = 273К; Rв - газовая постоянная воздуха, Rв = 287 Дж/(кг•К); µ - молекулярная масса. Для воздуха µ = 28,97 кг/кмоль; 22,4 - объем киломоль идеального газа при нормальных физических условиях, м3/кмоль. Теплоёмкость зависит от характера термодинамического процесса, в котором подводится и отводится теплота. При экспериментальном определении ее значения обычно используют два термодинамических процесса, протекающих при постоянном объеме (V=const) и давлении (P=const), а такие теплоемкости называют изохорной или изобарной. Изохорная теплоемкость
Для нормальных физических условий
где µR - универсальная газовая постоянная, µR = 8314, 2 Дж/(кмоль•К). Отношение изобарной теплоёмкости к изохорной называют показателем адиабаты
Используя отношение (3) и зная К, можно определить:
Теплоёмкость зависит от температуры. В зависимости от интервала температур различают истинную С и среднюю Cm удельные теплоемкости. Истинной называют теплоемкость, соответствующую бесконечно малому интервалу температур:
Количество теплоты, необходимое для нагревания единицы количества на один градус в интервале температур, называют средней теплоемкостью.
Для многих теплотехнических расчетов зависимость теплоемкости от температуры принимают либо линейной C = a + bt, либо выраженную рядом C = a + bt + …, где a, b, d - постоянные, зависящие от природы газа. Поскольку
где Теплоёмкость идеальных газов однозначно зависит от температуры. Величина теплоемкости реальных газов зависит также и от давления, влияние которого при высоких температурах (около 1000 °С) незначительно. У водяного пара при давлениях ниже критического с повышением давления при низких температурах теплоемкость растет медленно, а при высоких быстро увеличивается, достигая при критической температуре бесконечности. При увеличении давления выше критического с ростом температуры теплоемкость постепенно уменьшается. Энтальпии - термодинамическая функция, имеющая смысл полной (внутренней или внешней) энергии системы, равна i = U + PV. Энтальпий i и внутренняя энергия U идеального газа зависят только от температуры и при t = 0 °C принимаются равными нулю и вычисляются по формулам:
Таблицы теплоемкостей и термодинамических функций воздуха в зависимости от температуры даны в прил. 1,2.
Экспериментальная установка
Установка для определения объемной изобарной теплоемкости воздуха методом проточного калориметрирования показана на рис. 1.
Рис. 1. Схема экспериментальной установки Воздух объемным насосом 1 подается в калориметр 2, в котором размещен электрический нагреватель 3. Мощность, потребляемая нагревателем, устанавливается регулятором напряжения 5 и измеряется ваттметром 6. Температура воздуха на входе в калориметр и выходе из него измеряется термометрами 4 и 7. Количество воздуха, прошедшее через систему за определенный промежуток времени, определяется по объемному расходометру 8.
Порядок выполнения работы 1. Ознакомиться с описанием установки, измерительной аппаратурой и требованиями техники безопасности. 2. Включить насос. Э. Регулятор напряжения поставить в нулевое положение и включить нагреватель калориметра в сеть. 4. Ручкой регулятора подать напряжение, установив мощность нагревателя по заданию преподавателя. 5. При данной мощности после установления постоянной температуры воздуха на выходе из калориметра записать показания ваттметра, температуры воздуха не входе в калориметр и выходе из него, давление воздуха, показания объёмного расходометра. С интервалом в 5 минут сделать 2 замера. 6. Ручкой регулятора установить напряжение в нулевое положение, отключить нагреватель от электросети, выключить насос. 7. Опытные данные завести в журнал наблюдений (табл.1). Таблица 1 Журнал наблюдений
Обработка опытных данных
1. По опытным данным вычисляем объемную среднюю изобарную теплоёмкость
где Q - количество теплоты, подведенное к воздуху в калориметре, кДж/с
где W - мощность, подаваемая на электронагреватель, Вт; φ - коэффициент расхода объемного расходомера; T1 и T2 - температура воздуха на входе в калориметр и выходе из него, К; Vн - объём воздуха, прошедшего через калориметр, приведенный к нормальным физическим условиям, м3/с. Для определения приведенного объёма следует воспользоваться соотношением
где левая часть представляет параметры воздуха на входе в калориметр, т.е. в помещении лаборатории, а правая - параметры воздуха при нормальных физических условиях.
2. Пользуясь зависимостями (1) и (2), вычислить средние массовую и молярную теплоемкости, а также средние массовую, объемную и молярную изохорные теплоемкости. 3. Из соотношения (3) определить показатель адиабаты К. 4. Пользуясь выражением (4) и зависимостями (1) и (2), вычислить средние теплоемкости по табличным значениям. 5. Из выражений (5) и (6) определить внутреннюю энергию и энтальпию воздуха при температуре t2 на выходе из калориметра. 6. Определить, при какой температуре с учетом принятых условий будет начало отсчета внутренней энергии воздуха, для чего воспользоваться выражением 7. Полученные значения изобарных и изохорных теплоемкостей, энтальпии и внутренней энергии сравнить с табличными их значениями и занести в табл. 2. Таблица 2
Вопросы для самоконтроля 1. Определение удельной теплоемкости. 2. Понятие средней и истинной теплоемкости. 3. Уравнение Майера и смысл величин, входящих в него. 4. Какая из двух теплоемкостей Cp или Cvбольше и почему? 5. От чего зависит теплоемкость газов? 6. Определить теплоемкость изотермического и изобарного процессов. 7. Написать уравнение средней, массовой, молярной и объемной теплоёмкости для смеси газов. 8. Как изменилось бы значение теплоемкости (стало завышенным или заниженным), если бы показания приборов были сняты до установления стационарного режима. 9. Понятие внутренней энергии. Отличие внутренней энергии идеального газа от реального. 10. Понятие энтальпии. Выражение первого закона термодинамики через энтальпию.
Поиск по сайту: |
 , кДж/(м3•К) и молярную
, кДж/(м3•К) и молярную  , кДж/(кмоль•К) теплоемкости. Связь между ними выражается соотношениями
, кДж/(кмоль•К) теплоемкости. Связь между ними выражается соотношениями ;
; 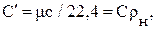 (1)
(1) - плотность газа при нормальных физических условиях, кг/м3.
- плотность газа при нормальных физических условиях, кг/м3.
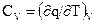 , а изобарная
, а изобарная  . Представленная в изохорном процессе теплота расходуется только на изменение внутренней энергии, так как
. Представленная в изохорном процессе теплота расходуется только на изменение внутренней энергии, так как  . В изобарном процессе теплота расходуется как на изменение внутренней энергии, так и на совершение работы, поэтому для изменения температуры тела из 1 К при Р = const требуется большее количество теплоты, чем при V = const, и, следовательно, Cp > Cv. Связь между изобарной и изохорной теплоемкостями установлена в 1842г. Р. Майером.
. В изобарном процессе теплота расходуется как на изменение внутренней энергии, так и на совершение работы, поэтому для изменения температуры тела из 1 К при Р = const требуется большее количество теплоты, чем при V = const, и, следовательно, Cp > Cv. Связь между изобарной и изохорной теплоемкостями установлена в 1842г. Р. Майером.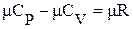 ;
;  ;
; 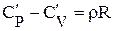 (2)
(2)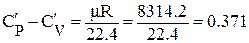 кДж/(м3•К),
кДж/(м3•К),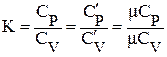 . (3)
. (3) и
и 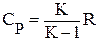 .
. .
. .
. , то
, то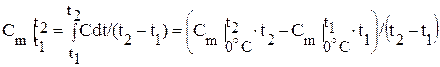 , (4)
, (4)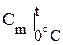 - средняя теплоёмкость в --- температур от 0 °С до t °C; t1 и t2 - температуры интервала, °С
- средняя теплоёмкость в --- температур от 0 °С до t °C; t1 и t2 - температуры интервала, °С ; (5)
; (5) ; (6)
; (6)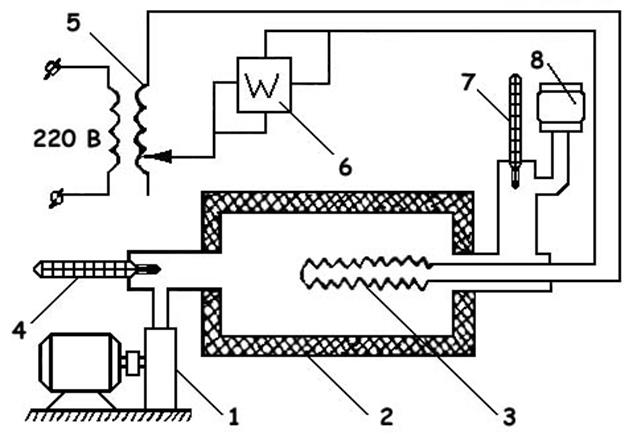
 ,
,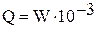 ,
,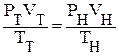 ,
,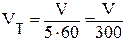 - объем воздуха, прошедшего через калориметр в условиях опыта, м3/с.
- объем воздуха, прошедшего через калориметр в условиях опыта, м3/с. .
.