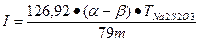|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Методика синтезу лакового пігменту з основного барвника
Приготувати 0,8% розчин основного барвника (за вказівкою викладача) у склянці ємністю 0,5 л кількістю 0,3 л і додати до нього 'А частину' отриманого раніше друкарського білила і ретельно перемішати. В іншій склянці методом послідовного розчинення приготувати розчин з (NH4)2MoO4, Na2HPO4 та НС1, взятих у еквімолекулярних співвідношеннях. Взаємодія названих елементів призведе до утворення Н3[P(Мо2O7)6] і NaCl плюс NH4CI. Не розділяючи отримані солі, що виконують роль осаджувачів, додати до розчин}' основного барвника, який знаходиться в першій склянці. В результаті реакції утворюється осад лакового пігменту з основного барвника. Перевірити повноту осадження барвника за допомогою краплі розчину, розміщеної на фільтрований папір. Якщо біля краплі утвориться кольоровий ореол, то необхідно додати ще осаджувача. Отриманий лак промити дистильованою водою, відокремити фільтрацією на вакуумфільтрі від промивної води і висушити у вакуумній шафі при температурі 60-70°С. Контрольні запитання 1. Що таке пігменти? 2. Які за кольором бувають пігменти? 3. З якою метою в поліграфії застосовують пігменти? 4. Загальні характеристики пігментів. 5. Способи одержання пігментів. 6. Як одержати сульфат барію? 7. Що собою представ.ляє гідроксид амонію? 8. Як одержати друкарські білила? 9. Які відомі чорні пігменти? 10. Яка структура і властивості чорних пігментів. 11. Як підсилюють колір чорних пігментів? 12. Як одержують саясу і чим відрізняється канальна сажа від грубної? 13. Як одержати кольорові пігменти? 14. Що таке мілорі і які характеристики він має? 15. Що таке металеві пігменти? 16. Як одержують металеві пігменти? їх основні поліграфічні характеристики. 17. Як одержати дисульфід олова? 18. Які загальні характеристики мають органічні барвники? 19. Що таке функціональні групи? 20. Які функціональні групи зустрічаються в органічних барвниках? 21. Що таке хромоформні групи і як вони впливають на колір барвника? 22. Що визначають кислотні або основні групи у складі барвника? 23. За якими розділяють застосування барвників? 24. Що таке лакові пігменти (барвисті лаки)? 25. Як утворюються лакові пігменти? 26. Як синтезувати лакові пігменти з кислотних барвників? 27. Як синтезувати лакові пігменти з основних барвників? 28. Як перевірити повноту осадження? 29. Які загальні характеристики лакових пігментів?
4.1 Мета роботи
Вивчити методики й експериментально визначити: кислотне число в оліфах, числа омилення, йодне число, як основних характеристик сполучних застосовуваних при виготовленні фарб, а також навчитися визначати в’язкість фарби і її взаємодію з розчинниками, кислотами, гідроксидами і водою.
4.2 Вказівки з організації самостійної роботи
Під час підготовки до виконання лабораторної роботи необхідно вивчити теоретичні матеріали за літературними джерелами ([1], с. 178-196; [2], с. 129-159), а також методичні вказівки до лабораторних робіт. Підготувати відповіді на контрольні запитання.
4.3 Плівкоутворювачі
Друкарські фарби представляють багатокомпонентні системи, що складаються з пігментів, наповнювачів і сполучного, в якому вони диспергіровані. Основним компонентом сполучного є плівкоутворювальні, які утворюють тверду плівку в процесі закріплення фарби. В’язкість сполучних регулюється введенням необхідної кількості активних розчинників. Пасивні й активні розчинники вилучаються з фарби і сполучного усмоктуванням і випаром. Сполучні мають містити активні групи, які визначають фізико-хімічні процеси закріплення полімеризацією. В залежності від умов закріплення сполучного їх розділяють на п’ять груп. До першої групи відносяться сполучні, які утворюють плівки в процесі хімічних реакцій: окислювання, фото - або термополімеризації. Прикладом таких сполучних є оліфи з рослинних олій. Вони утворюють плівку в результаті окисної полімеризації. Швидкість утворення плівки залежить від природи оліфи, часу й умов її збереження. Основними показниками якості сполучного на основі оліф є: 1. Кислотне число Кч - характеризує вміст вільних жирних кислот і з часом збільшується при збереженні. 2. Число омилення Ч0 - характеризує вміст вільних і зв’язаних кислот, я и сповільнюють процес полімеризації' (плівкоутворення). 3. Йодне число Іч - усереднена кількість ненасичених подвійних зв’язків. Швидкість плівкоутворення пропорційна величині йодного числа. 4.4 Визначення кислотного числа
Кислотне число - це кількість гідроксиду калію (КОН) або гідроксид у натрію NaOH у мг, необхідна для нейтралізації вільних кислот у 1 г досліджуваного сполучного. Методика На аналітичних вагах у колбі ємністю 250 мл зважити 2-2,5 г сполучного і розчинити наважку , додаючи до неї 20 мл спирту, додати 2-4 краплі фенолфталеїну і провести титрування 0,5 N розчином (КОН), спостерігаючи зміну забарвлення від слабко жовтої до слабко рожевої. Титрування повторити з новою пробою сполучного і записати результати. Кислотне число - Кч обчислити за формулою:
де
Колбу з продуктами титрування залишити для наступного досліду. Результати обчислень навести в зведеній таблиці.
4.5 Визначення числа омилення
Число омилення це кількість (КОН) у мг, необхідне для омилення всіх кислот у досліджуваному сполучному в ґ. Реакція нейтралізації органічних кислот розчином гідроксиду калію (КОН) зображується схемами: R - COOH + KON -» RCOOK + H20, HOOC - R1 - COOH + 2KOH KOOC - R1 - COOK + 2H2О. Методика У колбу з розчином, залишеним після визначення кислотного числа, додати 25 мл 0,5 N спиртового розчину (КОН). Колбу закрити зворотним холодильником і кип'ятити на водяній бані 30-40 хвилин. Колбу з розчином остудити до кімнатної температури, додати 3-4 краплі фенолфталеїну і титрувати 0,5 N розчином НС1, до зміни забарвлення від оранжево-червоної до жовтої. Розчин залишити для наступного досліду. Число омилення - Ч0 обчислити за формулою:
де а - кількість НС1, що витрачена на титрування в мл; Tkon - 0,02258 - титр розчину KON ; ТHCl - 0 ,01830 - титр розчину НСl; т - наважка сполучного в г; коефіцієнт -1,537 обумовлений еквівалентом КОН і НСl. Результати обчислень навести в зведеній таблиці.
4.6 Визначення йодного числа
Йодне число - це кількість йоду в %, яка може приєднуватися до місць з подвійними зв’язками сполучного за схемою: R - HC = СН - COOK + Ь -> R - НС- С- COOK І І Методика Розчин, залишений після попереднього досліду, перелити в мірну колбу об’ємом 100 мл, долити спирт до риски, закрити пробкою і перемішати. Взяти дві колби ємністю по 500 мл, і в одну з них за допомогою піпетки відібрати і перенести 10 мл розчину з мірної колби. До цього розчину додати 25 мл 0,2 N спиртового розчину йоду і долити 200 мл дистильованої води. В другу колбу ємністю 500 мл налити 25 мл 0,2 N спиртового розчину йоду і долити 200 мл дистильованої води. Обидві колби інтенсивно струснути і помістити в темне місце на 5 хвилин. Через 5 хвилин надлишок йоду в двох колбах відгигрувати 0,1 N розчином гіпосульфиту натрію (Na2S2O3) до світло-жовтого забарвлення, після цього в колби додати по 5 мл розчину крохмалю (індикатора на йод) і продовжити титрування гіпосульфитом натрію до зникнення синього забарвлення. Йодне число обчислити за формулою:
де 126,92 - еквівалент йоду; 79 — еквівалент гіпосульфату натрію; TNa2S2O3 - титр гіпосульфіт; а - кількість розчину гіпосульфіпу, яке пішло на титрування в контрольному досліді; (З - кількість розчину' гіпосульфиту, яке пішло на титрування в досліджуваному розчині сполучного. Результати навести у звідній таблиці за формою: Характеристики сполучного
4.7 Вивчення в’язкості фарб
Властивості друкарських фарб залежать від властивостей компонентів їх утворюючих, температури навколишнього середовища і швидкості їхньої деформації. Форма, усмоктуюча здатність, розміри, міцність часток пігменту впливають на рухливість і стійкість фарби, а дисперсність і інтенсивність визначають криючу здатність. Взаємодія дисперсій фази із сполучиш і розчинниками забезпечує якість продукції за мінімальної витрати фарби. В’язкість фарби визначають різними методами; в’язкозимеграми, розтіканням і виміром обсягу фарби.
Методика Визначення в’язкості за виміром обсягу фарби полягає в тому, що між двома скляними пластинами роздавлюють навішення фарби і вимірюють обсяг циліндра, який утвориться. Для реалізації нього методу на аналітичних вагах зважують на склі 0,4-0,5 г досліджуваної фарби. На поверхню скла, поруч з навішенням фарби поміщають обмежуючі пластинки товщиною 0,05 мм. Поверхня фарби й обмежуючі пластинки закрити чистим склом і пригорнути одне скло до іншого, створюючи зусилля стиску напроти обмежуючих пластин. Між склом утвориться циліндр із фарби, висота якого дорівнює товщині обмежників, а діаметр визначається за допомогою вимірювального інструмента в двох взаємоперпендикулярних напрямках. В’язкість - d досліджуваної фарби обчислити за формулою:
де т - маса фарби (навішення фарби), r- радіус плями фарби, см; h- товщина обмежників, см. Експеримент повторити двічі, результати вимірювань усереднити і навести в звіті з лабораторної роботи.
4.8 Взаємодія фарби з розчинниками, кислотами, гідроксидами і водою
Фарби до висихання і після полімеризації сполучного повинні мати визначену стійкість до розчинників, в основному до спирту, а також кислотам, гідроксидам і воді. Для з’ясування стійкості фарби необхідно провести ряд дослідів. Методика На поверхню скляної пластинки покласти квадрати фільтрувального паперу з розмірами 40x40 мм змочені: перший 96% спиртом, другий - 5% розчином соляної кислоти, третій - 5% розчином гідроксиду натрію, четвертий - дистильованою водою. На кожний аркуш фільтрувального паперу покласти по аркушу фільтрувального паперу на який нанесена тонким шаром досліджувана фарба, накрити зверху склом і залишити в такому стані за нормальних умов на 5 хвилин. Через кожні 5 хвилин відзначати зміну забарвлення і записувати в таблицю:
Контрольні запитання 1. Які сполучні застосову ють у поліграфічних фарбах? 2. Чим характеризуються сполучні? 3. Що таке кислотне число, число омилення, йодне число і як вони визначаються? 4. Які основні характеристики мають поліграфічні фарби? 5. Що таке дисперсна фаза й у яких межах можуть мати розміри частки пігментів? 6. Як відрізняються частки пігментів за кольором? 7. Чим характеризуються розчинники? 8. Чим характеризуються розріджувачі? 9. Що таке кислотність наповнювача? 10. Як впливає збільшення кількості розріджувача на стійкість фарби?
Поиск по сайту: |

 - кількість розчину (КОН), витрачена на титрування, в мл;
- кількість розчину (КОН), витрачена на титрування, в мл;  - 0,02258 - титр розчину (КОН);
- 0,02258 - титр розчину (КОН); - наважка сполучного, в г.
- наважка сполучного, в г.