 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ. К жирорастворимым относят витамины А, D, Е и КСтр 1 из 6Следующая ⇒
К жирорастворимым относят витамины А, D, Е и К. О витаминах D и K будет рассказано в разделах, посвященных гемостазу и минеральному обмену. Витамин А. Ретиноиды. К группе витамина А (природных ретиноидов) в настоящее время относят: 1. all-транс-ретинол (витамин А1) – содержится в печени и жире морских рыб; 2. 3-дегидро-ретинол (витамин А2) – содержится в печени и жире пресноводных рыб, обладает 40% активности витамина А1; 3. all-транс-ретиналь; 4. ретиноевую кислоту.
Поскольку активность каждого из ретиноидов различна, их подвергают биологической стандартизации и часто дозируют в международных единицах активности (МЕ). 1МЕ соответствует активности 0,3 мкг ретинола или 0,6 мкг b-каротина, при этом 1МЕ ретинола эквивалентна 1МЕ b-каротина. Для учета различной эффективности ретиноидов и каротиноидов вводят понятие ретинолового эквивалента (RE). 1 мкг RE равен 1 мкг ретинола или 6 мкг b-каротина или 12 мкг других каротиноидов пищи. ФК: Лекарственные средства на основе витамина А вводят внутрь в виде эфиров, которые подвергаются гидролизу при участии гидролаз поджелудочной железы и слизистой оболочки кишечника. После того, как свободный витамин поступит внутрь эпителиальных клеток кишечника он вновь ресинтезируется в эфир пальмитиновой кислоты и в таком виде поступает в кровь. Внутримышечно витамин А вводят в виде эфира уксусной кислоты. Биодоступность витамина А не превышает 12% при любом из указанных путей введения. В крови витамин А соединяется со специальным ретинол-связывающим протеином (RBP), который образуется в печени. Витамин не связанный с этим белком является токсичным. Далее комплекс витамин А – RBP соединяется с еще одним белком – транстерритином, который препятствует фильтрации витамина в почках. На поверхности клеток-мишений в тканях располагаются рецепторы к RBP, которые отщепляют витамин А от белкового комплекса и переносят в цитоплазму клетки. Ретиноевая кислота поступает внутрь клетки путем липидной диффузии без участия рецепторов. Метаболизм витамина А протекает в печени, при этом он вначале окисляется до ретиноевой кислоты, а затем до окси- и эпоксиретиноевой кислоты, которые в виде глюкуронидов выделяются с желчью. Механизм действия и фармакологические эффекты ретиноидов. В организме каждый ретиноид выполняет свою роль: · ретиналь – обеспечивает работу световоспринимающих структур сетчатки; · ретинол – участвует в росте и дифференцировке тканей, работе репродуктивной системы, активации рецепторов тиреоидных гормонов и витамина D, тормозит апоптоз эпителиальных клеток; · ретиноевая кислота – обеспечивает дифференцировку тканей и усиление апоптоза эпителиальных клеток. Ретиналь. Обеспечивает процесс «сумеречного» или черно-белого зрения. Поступающий в организм ретинол подвергается изомеризации в 11-цис-ретинол, который затем окисляется до 11-цис-ретиналя. Поступая в фоторецепторные клетки сетчатки 11-цис-ретиналь протонируется в основание Шиффа и соединяется с e-аминогруппами остатков лизина белка опсина, при этом образуется родопсин (зрительный пурпур).
Схема 1. Участие витамина А в фоторецепции. ROL – ретинол, RAL – ретиналь, ФДЭ - фосфодиэстераза. Процесс перехода родопсина в батородопсин запускает фотон света. Под действием фотона света родопсин переходит в богатый энергией промежуточный продукт – батородопсин, из которого через несколько стадий образуется активный метародопсин II. Метародопсин II активирует особый G-белок трансдуцин, который присоединяет молекулу ГТФ и получившийся комплекс стимулирует цГМФ-зависимую фосфодиэстеразу – фермент, который разрушает цГМФ. цГМФ поддерживает натриевые каналы фоторецептора в активном состоянии, обеспечивая ток ионов натрия и выделение тормозного медиатора ГАМК. Действуя на ГАМКС-рецепторы ГАМК приводит к гиперполяризации мембраны нейронов. Разрушение цГМФ под влиянием фосфодиэстеразы приводит к закрытию каналов и прекращению тока натрия, в итоге из фоторецепторных клеток выбрасывается другой медиатор – глютамат и нейроны генерируют потенциал действия, который проводится в мозг и подвергается анализу. 11-цис-ретиналь в составе метародопсина II переходит в транс-форму, это приводит к распаду молекулы и выделению транс-ретиналя и опсина, в последующем транс-ретиналь способен вновь изомеризоваться в цис-форму и включаться в акт световосприятия. Ретинол и ретиноевая кислота. В цитоплазме клетки ретинол изомеризуется в 9-цис-ретинол, который окисляется вначале до 9-цис-ретиналя, а затем до 9-цис-ретиноевой кислоты. All-транс-ретиноевая кислота не подвергается никаким метаболическим изменениям в клетке. Таким образом, внутри клетки активными формами витамина А являются транс-ретиноевая кислота и 9-цис-териноевая кислота. Действие данной группы ретиноидов осуществляется через специальные цитозольные рецепторы. Кратко рассмотрим особенности данной группы рецепторов клетки.
Схема 2. Цитозольные рецепторы клетки. В верхней части представлена схема активации цитозольного рецептора. A-F – домены молекулы (пояснения смостри в тексте). Напротив каждого из типов рецепторов представлены обозначения его лигандов: GR – глюкокортикоидный рецептор, MR – минералокортикоидный рецептор, PR – прогестиновый рецептор, AR – андрогеновый рецептор, ER – эстрогеновый рецептор, TR – тиреоидный рецептор, RAR - рецептор ретиноевой кислоты, VDR – рецептор витамина D, PPAR – рецептор эйкозаноидов (пероксисомный пролифераторный рецеитор), EcR – экдизоновый рецептор, 9-cis-RAR – рецептор 9-цис-ретиноевой кислоты, NGFI-B – рецептор фактора роста нервов. Цитозольные рецепторы состоят из 6 доменов: A-F. Области A, B, D, F – вариабельные области, которые различаются у каждого вида, области С и Е - консервативные. Участок D является шарнирным участком, формирующим петлю рецептора. Участок C – ДНК связывающий участок, окружен 2 ионами Zn2+ (цинковые пальцы), при помощи которых он связывается со специфическими областями ДНК. Домен Е – лиганд связывающий участок, состоит из 3 a-спиралей, которые лежат в виде сэндвича, он способен связывать лиганды, подстраиваясь при этом под их конформацию. Все цитозольные рецепторы могут быть разделены на 4 семейства: · Гомодимерные рецепторы стероидных гормонов. При взаимодействии с молекулами гормонов рецепторы объединяются в пары из 2 одинаковых молекул, которые переносятся в ядро клетки и связываются с палиндромными последовательностями ДНК запускают процесс транскрипции ряда генов. Подробнее об этих рецепторах будет рассказано в разделе, посвященном стероидным гормонам. · Гетеродимерные рецепторы тиреоидных гормонов, ретиноидов, витамина D, эйкозаноидов. При взаимодействии с молекулой лиганда эти рецепторы объединяются в пары с RXR-рецептором и комплекс поступает в ядро клетки, где С-доменом связывается с рецепторным участком ДНК. Для ретиноидов рецептором является последовательность AGGTCA повторенная 5 раз. Активация этой последовательности запускает процесс транскрипции ряда генов. · Гомодимерные рецепторы 9-цис-ретиноевой кислоты (RXR-рецепторы) – представлены RXR-белками, которые связывают 9-цис-ретиноевую кислоту и, объединяясь в пары, поступают в ядро клетки, где активируют синтез ряда генов. · Мономерные рецепторы ростовых факторов. Связываются со своими лигандами (фактор роста нервов, трансформирующие факторы a- и b и др.) и поступают в ядро клетки, где активируют синтез ряда генов. Таким образом, ретиноевая кислота связывается с RAR-рецепторами II семейства, а 9-цис-ретиноевая кислота – с RXR-рецепторами III семейства и комплексы RAR/RXR и RXR/RXR транслоцируются в ядро, где при помощи нуклеофактора-kВ активируют геном клетки. Возникающие при этом эффекты представлены в следующих таблицах: Таблица 1. Эффекты ретиноевой кислоты (RAR/RXR-рецепторы)
Таблица 2. Эффекты 9-цис-ретиноевой кислоты
Рассмотрим применяемые в медицинской практике природные и синтетические ретиноиды. Ретинола ацетат (Retinole acetas, Vitamin A). Применение: 1. Профилактика гиповитаминоза А в группах риска (подростки, беременные и кормящие женщины), а также его лечение. Специфических критериев гиповитаминоза А нет. Наиболее значимыми симптомами являются: анорексия, замедление роста у детей, снижение иммунитета, приводящее к рецидивирующим инфекциям кожи, слизистых оболочек, дыхательных путей. При глубоком дефиците возможно появление язвенных поражений слизистых оболочек, ксерофтальмии (сухости роговицы) и кератомаляции (ее размягчения). Патогномоничным является нарушение ночного и сумеречного зрения (гемералопия). Часто развивается гиперкератоз кожи с возникновением папулезной сыпи. Следует помнить, что беременным женщинам назначать высокие дозы витамина А не рекомендуется (даже за полгода до планируемой беременности), в связи с доказанным тератогенным эффектом. Максимально допустимые дозы для беременных составляют 10.000 МЕ/сут и должны применяться только в случае если в рационе женщины отсутствуют фрукты и свежая зелень. 2. Для повышения резистентности организма в период эпидемий (совместно с витамином С). 3. При лечении рахита витамином D для снижения токсического и усиления терапевтического эффекта витамина D. 4. Местно для лечения ожогов, эрозий, язв, пролежней, трещин и отморожений. Режим дозирования: С профилактической целью назначают перорально в дозе 3.000-5.000 МЕ/сут. Лечебные дозы при гиповитаминозе легкой и среднетяжелой степени составляют 33.000 МЕ/сут внутрь или внутримышечно, а при развитии гемералопии и ксерофтальмии – 50.000-100.000 МЕ/сут внутримышечно в течение 1-3 сут с последующим переходом на поддерживающие дозы 3.000-5.000 МЕ/сут. Передозировка витамина А. Возникает при его ежедневном применении в дозе более 100.000 МЕ в течение месяца. Характеризуется повышением внутричерепного давления, что сопровождается головной болью, головокружением, тошнотой, рвотой. Появляется кожный зуд, эритема, дерматит, изредка возникает алопеция. На рентгенограмме обнаруживаются костные экзостозы, преждевременное закрытие зон роста у детей. Острое отравление витамином А возникает после употребления в пищу печени белого медведя (содержит 30.000 МЕ витамина А на 1 г массы, токсическая доза 30 г) или однократного применения более 1.000.000 МЕ витамина А. Проявляется резким повышением внутричерепного давления с головной болью, тошнотой, рвотой, спутанностью сознания, сонливостью. Возникает профузный понос быстро приводящий к обезвоживанию. На второй день появляется крупная папулезная сыпь, которая сменяется пластинчатым шелушением кожи, начиная с лица. Пальпация трубчатых костей (голени, предплечья и плеча) резко болезненна, вследствие поднадкостничных кровоизлияний. Меры помощи при интоксикации витамином А: 1) прекратить прием лекарственного средства; 2) введение небольших доз тироксина и преднизолона (ускоряют метаболизм витамина А и увеличивают синтез RBP); 3) введение глицерина или маннитола (осмотический диуретик) для снижения внутричерепного давления; 4) введение витаминов С и Е (эффективность данного мероприятия сомнительна и не доказана). ФВ: драже 33.000 МЕ; масл. раствор 3.300 и 5.000 МЕ в мягк. капсулах; масл. раствор для инъекций 25.000; 50.000 и 100.000 МЕ/мл в амп. по 1 мл. Ретиноевая кислота (Tretinoin, Retin-A, Vesanoid). Применение и дозирование: 1. Индукция ремиссии у больных острым промиелоцитарным лейкозом ранее не леченных или при рефрактерности к антрациклинам. В настоящее время установлено, что при данной форме лейкоза происходит транслокация части 15 хромосомы, которая содержит ген RAR-рецептора на 5, 11 или 17-хромосому. В итоге, образуется аномальный ген, который кодирует белок, связывающий ретиноевую кислоту в обход RAR-рецептора. Возникает дефицит кислоты в области рецептора и дифференцировка кроветворных клеток нарушается. Введение ретиноевой кислоты позволяет восполнить ее относительный дефицит, восстанавливается созревание клеток, а лейкозные клоны клеток подвергаются апоптозу. Обычная доза составляет 45-100 мг/м2/сут в 2 приема в течение 30-120 дней до возникновения ремиссии, после чего переходят на традиционные схемы консолидации ремиссии. Недостатком данного метода является достаточно высокая частота рецидивов лейкоза. 2. Acne vulgaris. Ретиноевая кислота усиливает пролиферацию сосочкового слоя кожи, снижает адгезию клеток кожи друг к другу. Это способствует удалению кератиновых пробок, переходу закрытых угрей в открытые и их заживлению без рубцевания. Предотвращается образование новых угрей. Максимальный терапевтический эффект возникает через 8-12 недель после начала лечения. При лечении крем наносят 1 раз в день на вымытую сухую поверхность кожи и распределяют равномерно пальцем. Недопустимо сочетать ретиноевую кислоту с лекарствами, которые способствуют десквамации эпителия (бензолипероксид, салициловая кислота), а также у пациентов с загаром (применение кислоты следует отложить до его ослабления). НЭ: 1. Депрессия, попытки суицида. 2. «Сидром ретиноевой кислоты» - обусловлен повышением количества лейкоцитов в крови, что приводит к развитию лейкоцитарной инфильтрации внутренних органов: легких (одышка, плевральный выпот, рентгенологически – облаковидные инфильтраты), печени и почек (почечная и печеночная недостаточность), гипертермия. 3. Гипертриглицеридемия и гиперхолестеринемия. 4. Тошнота, рвота, диарея. 5. Сухость слизистых оболочек и кожи, дерматит, ксерофтальмия. 6. Подкожные, меммышечные и поднадкостничные кровоизлияния. 7. Тератогенное действие. При использовании ретиноевой кислоты у женщин рекомендуется применять 2 метода контрацепции на протяжении всего курса лечения, а также в течение 1 месяца до и после курса терапии. ФВ: капс. по 10 мг; крем 5%-30,0
ФК: Хорошо абсорбируется из ЖКТ, но прием во время еды увеличивает абсорбцию и биодоступность в 2 раза. Хорошо проникает через гистогематические барьеры, в том числе через плаценту и в молоко матери. Метаболизируется в печени. Выводится из организма в соответствии с кинетикой нулевого порядка, т.е. за единицу времени элиминируется строго определенное количество вещества, поэтому период полуэлиминации установить невозможно (7-39 часов в зависимости от дозы). Выделяясь с желчью в кишечник подвергается повторному всасыванию в кровь (энтерогепатическая циркуляция) и поступлению в печень. ФЭ: 1) себостатический – снижение выработки кожного сала; 2) противовоспалительный; 3) керато- и иммуномодулирующий – повышение устойчивости кожи к действию повреждающих факторов и микроорганизмов. Показания к применению и режимы дозирования: 1. Себорея, пустулезные и розовые угри, периоральный дерматит. Применяют мазь, которую наносят тонким слоем на пораженные участки 2 раза в день, равномерно распределяя специальным аппликатором в одно движение. Запрещается втирать мазь. Длительность курса терапии 4-6 недель. 2. Тяжелые формы узелково-кистозных угрей с локализацией на туловище и наклонностью к рецидивированию. Принимают внутрь вначале в течение 4 недель по 0,5 мг/кг/сут в 1 прием во время еды, затем в виде поддерживающей дозы 0,1-1,0 мг/кг/сут. Общая продолжительность курса 16 недель. Через 8 недель курс можно повторить. НЭ: · Кожные: сухость слизистых оболочек глаз, рта, полости носа и глотки, дерматит, паронихия, дистрофия ногтей, разрастание грануляционной ткани в пораженной области, алопеция. В начале лечения возможно кратковременное ухудшение состояния. · ЦНС и органы чувств: светобоязнь, конъюнктивит, катаракта, снижение слуха, головная боль, судороги, депрессия, суицидальные попытки. · ЖКТ: тошнота, повышение уровня трансаминаз, гепатит. До начала лечения следует проконтролировать функцию печени, в последующем контрольные исследования проводят через 1 месяц после начала лечения и далее каждые 3 месяца. · Кровь: анемия, нейтропения, изменение количества тромбоцитов, гиперхолестеринемия, повышение уровня ЛПНП и снижение ЛПВП. · Опорно-двигательная система: боли в мышцах и суставах, гиперостозы. · Тератогенный эффект (гидроцефалия, микроцефалия, эксэнцефалия, девормации ушных раковин, отсутствие слухового прохода, микрофтальмия, пороки сердца, мозжечка, вилочковой и паращитовидных желез). Рекомендуется применять 2 метода контрацепции на протяжении всего курса лечения, а также в течение 1 месяца до и после курса терапии. · Фотосенсибилизация. ФВ: капсулы по 10 и 20 мг; мазь 0,01; 0,05 и 0,1% по 10,0; 20,0 и 35,0; ректальные свечи по 20 и 50 мг.
ФК: После перорального приема этретинат всасывается практически полностью и в течение 2-3 часов метаболизируется до фармакологически активного метаболита – ацитретина. Период полувыведения ацитретина составляет 50 часов, этретината – более 120 дней (что обусловлено депонированием его в организме). Выделяется на 80% с желчью и 20% с мочой. Метаболиты, выделившиеся с желчью, подвергаются энтерогепатической циркуляции. ФЭ: Нормализация ороговевания эпителия кожи. Показания к применению: 1. Тяжелые дискератозы – псориаз, псориатическая эритродермия. 2. Врожденный ихтиоз. 3. Болезнь Дарье. 4. Красный отрубевидный лишай. В настоящее время в клинической практике чаще применяют метаболит этретината ацитретин (неотигазон), что связано с его более быстрым выведением из организма и отсутствием способности к депонированию. Режим дозирования: Применяют 1 раз в день во время еды, запивая молоком. Начальная доза 25-30 мг/сут в течение 2-4 недель, в последующем переходят на поддерживающую дозу 25-75 мг/сут в течение 6-8 недель. НЭ: аналогичны эффектам изотретиноина. Ввиду способности препарата к депонированию и тератогенного действия у женщин детородного возраста необходима двойная контрацепция в течение всего периода лечения, а также за 1 месяц до него и в течение 2 лет после окончания терапии. Применение этретината у данной категории пациентов возможно только в том случае, если возможная польза перевешивает риск от его применения (например, тяжелое течение болезни с нарушением подвижности и т.п.). ФВ: капсулы по 10 и 25 мг. Токоферола ацетат (Tocoferoli acetas, Vitamine E acetate, Evitol). Витамин Е представлен 8 токоферолами, имеющими разную биологическую активность (см. табл. 3). Наиболее активным является RRR-d-a-токоферол, активность которого принята за 100%.
Для определения дозы витамина Е используют как весовые единицы, так и единицы биологической активности (МЕ). При этом считают, что активность 1 мг a-токоферола составляет 1,49 МЕ, а его ацетилового эфира – 1,36 МЕ. МД: 1) взаимодействует с негистоновыми белками хромосом и регулирует процессы экспрессии ряда генов; 2) связывает пероксидные радикалы в 1000 раз быстрее, чем молекулы ненасыщенных жирных кислот, обрывая тем самым реакции ПОЛ в липидной фазе. ФК: В медицинской практике витамин Е применяют в виде эфиров уксусной или янтарной кислот, которые вводят внутрь или внутримышечно. Всасывание витамина Е происходит в кишечнике, после гидролиза, при участии переносчиков (активный транспорт). Вначале витамин Е включается в состав хиломикронов, а затем ЛПНП. a-токоферол поступает во все ткани, депонируясь в мембранах клеток (главным образом сетчатки, печени, мышцах и жировой ткани). Элиминация его из орагнизма происходит с желчью, при этом в кишечнике часть вещества вновь всасывается, участвуя в энтерогепатической циркуляции. ФЭ: 1. Активация синтеза коллагена в коже, костях, соединительной ткани; сократительных белков в скелетных мышцах и миокарде, ферментов печени и кретинфосфокиназы. 2. Стимуляция синтеза гонадотропных гормонов. 3. Ко-фермент синтетазы d-аминолевулиновой кислоты – ключевого фермента синтеза гема, входящего в состав гемоглобина, миоглобина, цитохромов дыхательных цепей и микросом. 4. Активация ферментов синтеза кофермента Q, АТФаз, каталазы и пероксидазы. 5. Торможение процессов ПОЛ в липидной фазе. Дефицит витамина Е у человека не описан. В экспериментальных условиях у крыс удалось воспроизвести дефицит этого витамина, который проявлялся: 1) бесплодием (стерильностью); 2) дегенерацией двигательных ядер спинного и продолговатого мозга; 3) дегенерацией мышц и миокарда; 4) гемолитической и гипопластической анемией. Попытка механически перенести эти симптомы на человека привела к формированию необоснованных и бездоказательных показаний для его применения: · Миопатии и миокардиодистрофии. Имеются лишь единичные, неподтвержденные сообщения о некотором торможении прогрессирования заболевания при использовании витамина Е. · Лечение бесплодия и привычного выкидыша. Витамин необходим для нормального функционирования репродуктивной системы грызунов, но у человека он не играет ключевой роли в этих процессах. · Лечение атеросклероза, профилактика инфаркта миокарда. В ряде проспективных исследований было показано, что эффект a-токоферола не отличается от эффекта плацебо. · Профилактика рака и злокачественных новообразований. В 1994 г. было проведено рандомизированное исследование в котором было четко установлено, что прием a-токоферола не только не снижает риска возникновения рака, но в больших дозах даже повышает риск рака легких на 18%. Показания к применению и режимы дозирования. В настоящее время относительно доказанными можно считать только следующие показания к применению этого витамина: · Профилактика ретролентальной фиброплазии и пигемнтной дегенерации сетчатки у новорожденных и недоношенных детей, которые получают оксигенотерапию и препараты железа. Это связано с тем, что кислород и железо вызывают бурное образование свободных радикалов и повреждение мембран клеток. Витамин Е назначают в дозе 100 мг/кг/сут внутрь. · Дефицит глюкозо-6-фосфат дегидрогеназы. Наследственное заболевание, при котором нарушаются процессы восстановления глютатиона в эритроцитах и снижается их стойкость к сильным окислителям. Прием лекарственных средств (или употребление продуктов питания) с высоким окислительным потенциалом вызывает у таких лиц гемолиз. Назначают витамин Е в дозе 100 мг/сут. · Акантоцитоз – наследственное отсутствие ЛПНП. Витамин Е применяют в дозе 100 мг/нед внутримышечно. При введении чрезмерно высоких доз витамина Е может развиться острый гипервитаминоз, который проявляется: · Угнетением свободнорадикальных реакций в лейкоцитах, обеспечивающих нормальное переваривание антигенов. В итоге понижается иммунитет, развивается сепсис. · Прямым токсическим повреждением кишечника (некротический энтероколит), печени и почек (почечная недостаточность, гепатоспленомегалия, гипербилирубинемия). · Угнетением активности витамин К-зависимых ферментов с развитием кровоточивости, кровоизлияниями в сетчатку, мозг. ФВ: драже по 150 мг; раствор масл. 50% в мягк. капсулах по 0,2 и 0,5; раствор масл. 5, 10 и 30% в амп. по 1 мл; раствор масл. 5, 10 и 30% для применения внутрь во флак. по 15,0; 20,0; 25,0; 30,0 и 50,0. ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ[2]. Тиамина хлорид (Thiamine chloride, Vitamin B1) Тиамин описан в литературе как витамин В1, витамин F или аневрин. В кристаллическом состоянии он стабилен при температуре 100°С. Водные растворы тиамина при рН < 5,0 устойчивы к действию высоких темпе Пищевая роль. Несмотря на то, что тиамин широко распространен в продуктах растительного и животного происхождения, основным его источником являются:
В незначительном количестве тиамин синтезируется микрофлорой кишечника, но при этом нет убедительных данных, что синтез тиамина в кишечнике является доступным источником витамина. Суточная потребность в тиамине составляет »1,0-2,0 мг, но может изменяться в зависимости от количества потребляемых углеводов. В среднем считают, что необходимо »0,3 мг тиамина на каждые 1000 ккал пищи. Таблица 4. Суточная потребность в витаминах для разных категорий людей.
МД: В организме тиамин в стенке кишечника превращается при участии АТФ в моно-, ди- и трифосфаты. Наиболее активной является дифосфатная форма – тиаминпирофосфат, которая выступает в роли кофермента следующих ферментов: · Пируватдекарбоксилазы – фермент обеспечивает окислительное декарбоксилирование пировиноградной кислоты с образованием ацетил-КоА, который в дальнейшем используется для синтеза жирных кислот, стероидных гормонов, ацетилхолина. · a-кетоглутаратдегидрогеназы – фермент цикла трикарбоновых кислот, обеспечивает синтез НАДН·Н+, необходимый для образования АТФ. · Транскетолазы – фермент пентозофосфатного пути превращения углеводов. Участвует в синтезе нуклеотидов, жирных кислот и аминокислот. ФК: Тиамин можно вводить внутрь, внутримышечно и внутривенно (в последнем случае только капельно, очень медленно). Всасывание тиамина в кишечнике происходит в его проксимальных отделах, главным образом, путем активного транспорта, при помощи специальной Na+/тиамин-АТФазы. Насыщение фермента происходит в дозе »10 мг тиамина (»2 мкмоль/л). В более высоких дозах часть витамина может поступать путем пассивной диффузии. Еще в процессе всасывания тиамин подвергается фосфорилированию в коферментные формы в стенке кишечника и печени. Транспорт тиамина в крови происходит в связанном с альбуминами состоянии. Тиамин хорошо проникает во все органы и ткани (в том числе и через гематоплацентарный барьер, при этом его концентрация у плода превышает уровень витамина в крови матери). Наибольшие количества тиамина содержат скелетные мышцы (»50% всего количества), миокард, печень и мозг. Элиминация тиамина осуществляется путем его деградации в печени (при этом образуется до 10 метаболитов, которые удаляются с мочой). Период полуэлиминации тиамина 9-18 дней. Всего в сутки метаболизируется до 1 мг тиамина. ФЭ: 1. Тиамин регулирует углеводный обмен, обеспечивает его взаимосвязь с процессом липогенеза. 2. За счет декарбоксилирования пировиноградной, a-кетоглутаровой кислот и других a-кетокислот тиамин позволяет быстро ликвидировать метаболический ацидоз. 3. Облегчает нервно-мышечную проводимость. Данный эффект связан, по крайней мере, с двумя механизмами. С одной стороны, тиамин ингибирует активность холинэстеразы и замедляет, тем самым, разрушение ацетилхолина. За счет увеличения концентрации медиатора в нейро-мышечных синапсах передача импульсов облегчается. Кроме того, было установлено, что фосфорилированные формы тиамина (тиаминпирофосфат и тиаминтрифосфат) могут связываться с Na+-каналами скелетных мышц вблизи воротного механизма. При прохождении нервного импульса, тиамин дефосфорилируется и открывает натриевые каналы даже в отсутствии медиатора, вызывая при этом мышечное сокращение. Показания к применению и режимы дозирования: 1. Лечение авитаминоза В1 («бери-бери»). Различают 2 формы болезни – «сухую» и «влажную». [ «Сухая» бери-бери проявляется в основном неврологическими симптомами – полиневритами с выпадением чувствительности, гиперестезиями (ощущением покалывания и ползанья «мурашек»). Развивается мышечная слабость и атрофии мышц, которые проявляются симптомами «свисающих кистей и стоп» (пациент не может удерживать кисть и стопу на весу в горизонтальном положении). Наблюдаются нарушения мышления, памяти, замедление психических процессов. Со стороны ЖКТ отмечается потеря аппетита, запор. [ «Влажная» бери-бери чаще проявляется у детей первых лет жизни. Ведущими являются кардиальные симптомы. Возникает тахикардия, одышка, кардиомегалия и другие симптомы сердечной недостаточности (но сердечный выброс при этом остается высоким, а не сниженным, как при классической форме сердечной недостаточности; это связано с тем, что на фоне дефицита тиамина происходит гиперактивация холинэстеразы и разрушение ацетилхолина с преобладанием симпатического тонуса). Возникающий дефицит белка приводит к снижению онкотического давления плазмы и развитию массивных отеков (анасарки). Лечение проводят путем внутримышечного или внутривенного введения тиамина в дозе 100 мг/сут до исчезновения симптомов заболевания, затем назначают поддерживающие дозы по 5-10 мг/сут внутрь. 2. Лечение энцефалопатии Вернике и Корсаковского психоза у лиц, страдающих хроническим алкоголизмом. Метаболизм этанола протекает путем его окисления до ацетил-КоА и требует, поэтому, большого количества тиамина для работы дегидрогеназ. Вследствие этого у пациентов возникает дефицит тиамина в нервной системе. Энцефалопатия Вернике проявляется спутанностью сознания, параличом глазодвигательных мышц (офтальмоплегия), нистагмом, тремором рук. Для Корсаковского психоза характерно сочетание фиксационной амнезии (выпадения памяти на только что произошедшие события) с симптомами полиневрита. Лечение проводят высокими дозами тиамина по 100 мг/сут внутримышечно. 3. Лечение редких наследственных заболеваний, связанных с нарушением обмена витамина В1: [ Лейциноз – нарушение декарбоксилирования аминокислот с разветвленной боковой цепью (лейцин, валин, изолейцин) вследствие дефицита дегидрогеназ a-кетокислот. Проявляется накоплением этих аминокислот в ткани мозга и вытеснением из синапсов естественных медиаторов – ГАМК и глютаминовой кислоты. Основные симптомы заболевания – приступы цианоза, ригидность мышц, тонико-клонические судороги, остановки дыхания – возникают через несколько дней после рождения ребенка. Моча приобретает запах кленового сиропа. Лечение проводят высокими дозами тиамина (10-20 мг/сут новорожденным и 50-100 мг/сут детям до 5 лет) и переводом ребенка на вскармливание искусственными смесями, лишенными разветвленных аминокислот. 4. Тиамин иногда применяют в высоких дозах внутривенно очень медленно (100 мг) для экстренного оказания помощи (временного протрезвления) при тяжелой алкогольной интоксикации. Полагают, что действие тиамина связано с тем, что он включается в процессы метаболизма ацетил-КоА и резко усиливает тем самым окисление этанола. В настоящее время тиамин довольно часто назначают в неврологии для лечения всевозможных невритов, невралгий, парезов, рассчитывая при этом на эффект, аналогичный таковому при лечении невритов у лиц с бери-бери. Однако, до настоящего времени нет убедительных доказательств об эффективности тиамина при этих состояниях, равно как и при использовании его для коррекции астенических состояний, иммунодефицитов, экземы и псориаза. НЭ: Прием тиамина может вызвать развитие аллергических реакций, вплоть до анафилактического шока. Синаптоплегия – состояние, которое возникает при быстром внутривенном введении тиамина, в результате чего создается очень высокая концентрация лекарства в крови и тиамин приобретает способность образовывать комплексы с различными медиаторами. При этом развивается падение АД, аритмия, нарушение мышечных сокращений (вплоть до паралича дыхательных мышц), угнетение ЦНС. ФВ: таблетки по 2, 5 и 10 мг; раствор 2,5 и 5% в ампулах по 1 мл.
МД: В организме рибофлавин превращается в коферментные формы – ФМН (флавинмононуклеотид) и ФАД (флавинадениндинуклеотид), которые входят в состав ферментов из группы оксидаз и редуктаз (т.к. они образуют окислительно-восстановительную систему), а также дыхательных цепей. ФК: Рибофлавин назначают внутрь, он хорошо всасывается в тонком кишечнике активным транспортом, сопряженным с переносом ионов натрия. Рибофлавиновые транспортеры полностью насыщаются при приеме доз »25 мг. В организме наибольшие количества витамина содержатся в сердце, печени, почках и мозге. Экскреция витамина осуществляется почками. ФЭ: · Рибофлавин формирует редокс системы дыхательных цепей и обеспечивает тканевое дыхание и нормальное функционирование бессосудистых эпителиальных тканей (хрусталик, эпидермис и др.). · Рибофлавин необходим для синтеза катехоламинов, т.к. он входит в состав фенилаланин-гидроксилазы и обеспечивает синтез L-ДОФА – предшественника дофамина и норадреналина в ЦНС и надпочечниках. · Рибофлавин стимулирует синтез эритропоэтина – основного стимулятора эритропоэза. · Рибофлавин входит в состав моноаминооксидаз (обеспечивают разрушение катехоламинов) и ксантиноксидазы (обеспечивает разрушение пуринов и синтез мочевой кислоты). Показания для применения и режимы дозирования. В настоящее время единственным показанием для применения рибофлавина является лечение авитаминоза – арибофлавиноза. Арибофлавиноз – крайне редкая форма авитаминоза, которая может возникнуть у пациентов с тяжелыми заболеваниями ЖКТ, сопровождающимися нарушением кишечной абсорбции питательных веществ (синдромом мальабсорбции). Основные симптомы арибофлавиноза могут быть объединены в 3 группы: [ Изменения эпителиальных тканей: наблюдается выпадение волос, развитие сосудов в роговице глаза, катаракта (помутнение хрусталика), себорейный фолликулярный кератоз носогубных складок; [ Изменения ЖКТ: хейлоз (воспаление красной каймы губ), ангулярный стоматит («заеды» - трещинки в углах рта), глоссит (воспаление слизистой оболочки языка, его «фуксиновая» пигментация), спру-подобные нарушения (обильная зловонная диарея с остатками пищи в фекалиях); [ Изменения ЦНС: ипохондрия, депрессия, судороги мышц и жжение подошв. В чистом виде арибофлавиноз редок, как правило он протекает как компонент полигиповитаминоза. Рибофлавин назначают внутрь по 2-20 мг/сут в зависимости от тяжести состояния. НЭ: Крайне редко может вызвать аллергические реакции, иногда способен привести к зеленой флуоресценции мочи (за счет образования люмохромов). ФВ: порошок для приготовления растворов; таблетки по 2, 5 и 10 мг.
ФК: После перорального или внутримышечного введения пантотеновая кислота хорошо всасывается и проникает в разные ткани, создавая наибольшие концентрации в печени, надпочечниках, сердце и почках. Выводится в неизмененном виде почками (70%) и печенью (30%). ФЭ: 1. Регулирует жировой обмен. Входит в состав ацилпереносящего белка пальмитат-синтазного комплекса (обеспечивает синтез липидов). Необходим для активации жирных кислот при первом этапе их b-окисления. 2. Обеспечивает процесс синтеза холестерина, стероидных гормонов, желчных кислот. Конденсация ацетил-КоА до мевалоновой кислоты – ключевая стадия синтеза всех этих соединений. 3. Обеспечивает синтез ацетилхолина в нейронах вегетативной и соматической нервной системы, облегчает передачу в холинергических синапсах. 4. Ацил-КоА переносит кислотные остатки на молекулы белков и жиров, модифицируя таким образом их функции: [ Обеспечивает ацетилирование N-конца полипептидной цепи и регулирует, тем самым, посттрансляционный процессинг белков. Так, в гипофизе в процессе трансляции образуется a-меланоцитстимулирующий гормон. Затем в средней доле гипофиза этот гормон ацетилируется и не разрушается, выполняя гормональную функцию. В передней доле гипофиза ацетилирования a-МСГ не происходит и он быстро расщепляется протеазами до b-эндорфина – гормона антиноцицептивной системы. [ Обеспечивает ацетилирование аминокислот внутри полипептидной цепи (обычно это e-аминогруппы остатков лизина). Так, например, микротрубочки клеток образованы димерами a- и b-молекул тубулина. Ацетилирование a-тубулина усиливает процесс его полимеризации, а деацетилирование – усиливает процесс его деградации. Ацетилирование гистоновых белков Н4, Н3, Н2А и Н2В (которые образуют ядро нуклеосомы) вызывает дестабилизацию нуклеосом и раскручивание ДНК для последующей транскрипции. [ КоА переносит на белки остатки жирных кислот (обычно это миристиковая кислота – С14 класс и пальмитиновая кислота – С16 класс). Миристоилированию подвергаются белки на N-конце которых расположен глицин: цитохром b5, цАМФ-зависимая протеинкиназа, кальцинейрин, a-субъединица G-белка. Без присоединения миристиковой кислоты все они не способны выполнять свою функцию. Миристоилированию подвергаются тяжелые цепи иммуноглобулинов в В-лимфоцитах – это обеспечивает их перенос в комплекс Гольджи и подготавливает к секреции из клетки. Пальмитоилированию подвергаются в процессе синтеза трансглютаминаза (белок кератиноцитов, который встроен в их мембрану и обеспечивает плотную адгезию клеток друг к другу), сурфактант легких, гликопротеин желудка. 5. В форме сукцинил-КоА принимает участие в синтезе протопорфириновых колец гема гемоглобина и цитохромов. Конденсация сукцинил-КоА с образование d-аминолевулиновой кислоты – ключевая стадия синтеза гема. 6. Оказывает выраженное анаболическое действие. По величине анаболического эффекта превосходит все другие витамины. Полагают, что в основе анаболического действия пантотената лежат несколько механизмов: [ Пантотенат оказывает «экономизирующее воздействие» на основной обмен, снижает процессы катаболизма, в первую очередь за счет уменьшения окисления белка. Фактически происходит перераспределение окислительных процессов: доля окисляемых белков снижается, а доля жиров возрастает. [ Под влиянием пантотената потенцируются эффекты инсулина и снижается уровень глюкозы в крови. Это способствует синтезу и выбросу соматотропного гормона гипофизом. Под влиянием СТГ резко усиливаются процессы синтеза белка. [ Пантотенат усиливает процессы стероидогенеза и образования эндогенных андрогенов – дигидроэпиандростерона и тестостерона, которые также усиливают синтез белка. [ Пантотенат увеличивает абсорбцию ионов калия в кишечнике и его поступление в мышцы. Ионы калия участвуют в процессах реполяризации мышц и обеспечивают эффективные мышечные сокращения. Установлено, что прием пантотената повышает общую переносимость физических нагрузок и выносливость, способствует приросту мышечной ткани. Показания для применения. Несмотря на такое многообразие эффектов нет научно обоснованных показаний для применения пантотената: его дефицит у человека не описан, а у животных воспроизведен только экспериментально. В настоящее время его применяют эмпирически при следующих состояниях: · Паралитическая форма кишечной непроходимости (например, у послеоперационных больных). Назначают по 300 мг каждые 6 часов внутрь или внутримышечно. Курс лечения до 2 месяцев. · Лечение хронической надпочечниковой недостаточности. Применяют внутрь по 200-400 мг 1-2 раза в день. Показано, что введение пантотената таким пациентам резко увеличивает количество в моче 17-кетостероидов (косвенный признак усиления функции коры надпочечников). · В спортивной медицине пантотенат применяют в период интенсивных тренировочных нагрузок (предсоревновательная подготовка и участие в соревнованиях) в дозах от 400 до 2000 мг/сут. НЭ: Иногда при приеме пантотената возникает тошнота, рвота, изжога. ФВ: порошок для приготовления растворов; таблетки по 100 мг; раствор 20% в ампулах по 2 мл. Никотиновая кислота (Nicotinic acid, Niacin, Vitamin PP) Ниацин – генерический собирательный термин, который обозначает как саму никотиновую кислоту, так и никотинамид. В настоящее время рекомендуют пользоваться именно этим названием витамина РР, поскольку слова «никотиновая кислота» достаточно часто ассоциируются у пациентов с никотином, содержащимся в табаке. Такие ассоциации могут вызвать неадекватное отношение пациента к лечению, тем более, что на самом деле ничего общего между алкалоидом табака и никотиновой кислотой нет.
В кукурузе и маисе ниацин содержится в достаточно большом количестве, но при этом он связан с углеводами в плохоусваиваемый ниацетин. Однако, в странах Центральной Америки, Мексике при изготовлении маисовых лепешек мука подвергается щелочной обработке (например, известковой водой), которая приводит к высвобождению ниацина и его биодоступность резко возрастает. Суточная потребность в ниацине составляет 15-20 мг или 6,6 мг на 1000 ккал пищи (но не менее 13 мг/сут). Следует учитывать, что ниацин – витамин, который может самостоятельно синтезироваться в организме человека. Его предшественником является незаменимая аминокислота триптофан, которая при участии витамина В6 трансформируется в хинолиновую кислоту, а затем, через ряд стадий в НАД (см. схему 3). Установлено, что 60 мг триптофана позволяют синтезировать 1 мг ниацина (т.н. ниациновый эквивалент). В связи с этим по мнению ряда экспертов можно питаться продуктами вообще лишенными ниацина, поскольку белок содержит »1% триптофана и диета, включающая более 100 г белка позволит обеспечить организм 1000 мг триптофана или 16,6 мг ниацинового эквивалента. МД: Витаминное действие ниацина связывают с образованием из него в организме НАД (никотинамидаденин динуклеотида) и НАДФ (никотинамидаденин динуклеотид фосфата). ФК: Ниацин при введении внутрь быстро всасывается в желудке и начальных отделах двенадцатиперстной кишки. Ниацин единственный из витаминов, который всасывается одновременно двумя механизмами – облегченным транспортом при помощи переносчика и водной диффузией. После абсорбции в кровь ниацин быстро депонируется в печени и эритроцитах (эритроцитарное депо содержит запасы, обеспечивающие потребность организма в течение »30 сут, печень »50-60 сут).
Схема 3. Образование активных форм витамина РР. ФРПФ – фосфорибозил пирофосфат, ПФ – пирофосфат, глн – глутамин, глу – глутаминовая кислота. ФЭ: 1. В настоящее время известно более 200 ферментов, кроферментами которых являются НАД и НАДФ. В форме НАД ниацин обеспечивает катаболические реакции (распад гликогена, окисление глюкозы) и работу дыхательных цепей. В форме НАДФ ниацин обеспечивает анаболические процессы – синтез белка, липидов, холестерина и стероидных гормонов. 2. Обеспечивает работу фермента поли-АДФ-рибозил трансферазы, который принимает участие в репарации и репликации ДНК, дифференцировке клеток (особенно кроветворного ряда). 3. Ниацин оказывает антиагрегантное действие (тормозит агрегацию тромбоцитов за счет уменьшения продукции тромбоксана А2 и выброса простациклина из эндотелия), повышает активность фибринолитической системы. При парентеральном введении он расширяет артериолы. Более подробно данный эффект ниацина охарактеризован в обзоре, посвященном средствам, влияющим на свертывание крови. 4. Ниацин участвует в реактивации родопсина после завершения акта фоторецепции. Он обеспечивает переход транс-формы ретинола в его цис-форму. 5. В больших (не витаминных) дозах ниацин оказывает гиполипидемическое действие – снижает синтез ЛПОНП и увеличивает включение холестерина в антиатерогенные ЛПВП. Более подробно данный эффект ниацина обсуждается в разделе, посвященном гиполипидемическим средствам. Применение. Как витаминное средство ниацин следует применять только по следующим двум показаниям: 1. Лечение авитаминоза – пеллагры. Пеллагра представляет собой симптомокомлекс, который включает синдром «трех Д – деменции, диареи и дерматита»: [ Деменциальный синдром – проявляется возникновением приступов необьяснимой тоски, ухудшения памяти, головных болей, бессонницы, онемения и парестезий конечностей. В последующем (через 2-3 года) появляются слуховые и обонятельные галлюцинации, эпилептиформные припадки. [ Диарейный синдром – диарея, сопровождающаяся стоматитом, глосситом, слюнотечением, тошнотой и рвотой. [ Дерматит – на коже рук, ног и лица появляются высыпания, которые напоминают солнечные ожоги, в последующем высыпания чернеют, подсыхают в виде корочек и трескаются. Для лечения пеллагры ниацин применяют в дозе 200-500 мг/сут, разделенной на 2 приема внутрь или внутримышечно. Улучшение наступает через 24-48 часов (хотя дерматит может сохраняться в течение нескольких недель). 2. Лечение болезни Хартнупа – рецессивное наследственное заболевание, при котором нарушается абсорбция триптофана. Ниацин назначают в дозе 25-100 мг/сут внутрь. Кроме этих показаний ниацин применяют для лечения следующих патологий в дозах, которые отличаются от физиологических витаминных доз: · Лечение дислипопротеинемий и атеросклероза – по 3,0-9,0 г/сут по специальной схеме. · Лечение облитерирующих заболеваний периферических сосудов (эндартериит, тромбангиит) и состояний, сопровождающихся повышенным риском тромбоза – вводят внутримышечно или внутривенно по специальной схеме. (Подробнее данные показания и режимы дозирования обсуждаются в соответствующих разделах.) НЭ: Быстрая абсорбция ниацина из ЖКТ или его парентеральное введение вызывают выброс гистамина из депо и активацию кининовой системы плазмы. У 50% пациентов это приводит к появлению весьма неприятного симптомокомплекса: · Падение АД с появлением эпизодов головокружения; · Покраснение верхней половины туловища, крапивница, кожный зуд, зуд и жжение при мочеиспускании; · Увеличение секреции желудочного сока, боли в эпигастральной области, изжога. Данных симптомов можно избежать, если начать прием ниацина с минимальных доз (12,5 мг/сут) и постепенно на 12,5 мг/сут повышать дозу до достижения желаемой. За 30 мин до приема ниацина можно назначить 250-300 мг ацетилсалициловой кислоты или Н1-гистаминоблокатор, которые также уменьшат выраженность данного симптомокомплекса. При длительном применении высоких доз ниацина могут появиться следующие симптомы: · Со стороны ЖКТ: анорексия, рвота, язвенные поражения, диарея, нарушение функции печени (повышение уровня трансминаз). Полагают, что гепатотоксический эффект высоких доз ниацина связан с тем, что он обедняет гепатоциты метильными радикалами (происходит интенсивное включение метила в процессы биосинтеза и уровень его доноров в клетке падает, способствуя развитию жировой дистрофии). Чтобы предотвратить или ослабить нежелательное воздействие ниацина на печень при использовании его высоких доз рекомендуют одновременно назначать доноры метильных групп – метионин, холина хлорид, L-карнитин; · Со стороны сердечно-сосудистой системы: мерцательная аритмия; · Со стороны обмена веществ: гипергликемия, гиперурикемия; · Со стороны кожи: acantosis nigricans – появление на коже ног черных пятен, покрытых «бархатными» ворсинчатыми выростами. ФВ: порошок, таблетки по 50, 100, 500 мг; раствор 0,1% в ампулах по 1 мл. Никотинамид (Nicotinamide) Амид никотиновой кислоты (ее витамер). По механизму действия и витаминной активности полностью идентичен ниацину.
Никотинамид переносится лучше, чем ниацин, поскольку он не вызывает рилизинга гистамина и активации кининовой системы. При его применении редко возникает падение артериального давления, появление кожной сыпи и зуда. ФВ: таблетки по 15, 25 и 50 мг; раствор 1 и 2,5% в ампулах по 1 и 2 мл.
Пищевая роль. Суточная потребность в витамине В6 составляет 2 мг для мужчин и 1,6-2,2 мг для женщин. Поскольку биологическая роль витамина тесно связана с обменом белка, то рекомендуемое количество витамина составляет 0,016-0,032 мг/г белка пищи. Витамин В6 широко распространен в продуктах питания – животные продукты содержат пиридоксаль и пиридоксамин, растительные – пиридоксин. Наиболее богаты витамином В6 следующие пищевые продукты:
МД: В печени все витамеры пиридоксина трансформируются в пиридоксаль, который подвергается фосфорилированию в коферментную форму – пиридоксаль фосфат. Присоединение кофермента к апобелку фермента происходит после того, как пиридоксаль фосфат образует основание Шиффа, которое фиксируется к e-аминогруппам остатков лизина в белке ферменте. ФК: Пиридоксин хорошо всасывается при введении внутрь или парентерально причем процесс абсорбции витамина в тонком кишечнике происходит путем пассивной диффузии и не является насыщаемым. Транспорт пиридоксина в крови протекает в связанном с альбуминами и гемоглобином эритроцитов состоянии. Основным депо пиридоксина в организме являются скелетные мышцы, которые содержат 80-90% всего пиридоксина организма. Выведение пиридоксина происходит с мочой в форме неактивной пиридоксовой кислоты. Период полуэлиминации составляет 25-33 дня. ФД: В настоящее время известно более 100 ферментов, использующих пиридоксаль фосфат в качестве кофермента. Основными являются трансаминазы, которые обеспечивают переаминирование a-кетокислот и синтез заменимых аминокислот. 1. В мышцах пиридоксаль фосфат входит в состав гликогенфосфорилазы и обеспечивает гликогенолиз. 2. Пиридоксаль фосфат входит в состав кинурениназы – фермента, который обеспечивает синтез из триптофана витамина РР. 3. Пиридоксаль фосфат обеспечивает работу декарбоксилаз в периферических тканях и ЦНС. Под влиянием этих ферментов происходит синтез основных центральных медиаторов: [ Глютаминовая кислота трансформируется в ГАМК; [ Тирозин трансформируется в дофамин и норадреналин; [ Триптофан переключается с кинуренинового пути метаболизма в ЦНС на серотониновый и трансформируется в серотонин (5-гидрокси-триптамин). Кинуренины являются возбуждающими медиаторами, тогда как серотонин выступает в роли тормозного. Таким образом, витамин В6 принимает участие в регуляции возбудимости ЦНС. 4. Пиридоксаль фосфат стимулирует синтез d-аминолевулиновой кислоты порфиринового кольца гема, увеличивает синтез сидерофиллина – железо-связывающего белка костного мозга. 5. Пиридоксаль фосфат связывается с e-аминогруппами лизина на поверхности тромбоцитов и фибриногена, вызывая тем самым замедление свертываемости крови и агрегации тромбоцитов. 6. Пиридоксаль фосфат связывается с e-аминогруппами лизина в аллостерических центрах рецепторов для стероидных гормонов (эстрогенов, андрогенов, гестагенов и кортикостероидов), препятствуя их транслокации в ядро клетки и реализации эффекта этих рецепторов. Применение и режимы дозирования. Дефицит пиридоксина в изолированной форме практически не встречается: уживотных авитаминоз удавалось воспроизвести только экспериментальным путем, у человека описано всего 3 случая изолированного авитаминоза. В настоящее время пиридоксин применяют при следующих состояниях: · Лечение гипохромной сидероахристической анемии. При этой форме анемии имеется дефицит синтазы d-аминолевулиновой кислоты и нарушается синтез протопорфиринового кольца гема. В результате, несмотря на высокий уровень железа в организме, оно не может включиться в гем и количество гемоглобина в эритроцитах падает (цветовой показатель крови снижается менее 0,8). Пиридоксин назначают по 50-200 мг/сут. · Лечение пиридоксин-зависимого судорожного синдрома у детей. Это наследственная патология, при которой нарушено декарбоксилирование глютаминовой кислоты в ГАМК (дефект декарбоксилазы глютаминовой кислоты). У таких детей через 2-4 часа после родов возникают тонико-клонические судороги, которые практически не устраняются обычными противосудорожными средствами. Пиридоксин назначают по 5-10 мг/сут длительно (до 3-5 лет). · При лечении изониазидом, гидралазином, циклосерином и D-пеницилламином часто возникают нейротоксические реакции, которые связывают со способностью этих лекарственных средств нейтрализовать витамин В6 в нейронах ЦНС, образуя с ним неактивные комплексы. Для предупреждения нейротоксического эффекта этих лекарств пиридоксин назначают из расчета 10:1 (т.е. на каждые 100 мг этих лекарств требуется 10 мг пиридоксина в сутки). · Эмпирически пиридоксин применяют у женщин, которые плохо переносят оральные контрацептивы. Использование пиридоксина в дозе 50 мг/сут позволяет устранить нейротоксические эффекты контрацептивов: повышенную возбыдимость, головные боли, нарушения сна. НЭ: В обычных дозах пиридоксин практически не вызывает нежелательных эффектов. Однако, следует помнить, что он усиливает синтез дофамина в ЦНС (который выполняет роль пролактостатина) и, поэтому, он может остановить лактацию у кормящих матерей. Пиридоксин несовместим с приемом леводопы у больных синдромом Паркинсона. За счет активации декарбоксилаз ЖКТ и печени пиридоксин будет вызывать практически полное разрушение леводопы еще до того, как она проникнет в ЦНС. Длительный прием больших доз пиридоксина может быть причиной двух весьма редких осложнений: [ Развития «пиридоксиновой зависимости» - генетически обусловленного состояния, которое возникает при длительном введении пиридоксина в дозе 100-200 мг/сут. При этом организм теряет чувствительность к физиологическим дозам витамина и попытка отменить пиридоксин вызывает картину тяжелого авитаминоза (себорея, глоссит, спутанность сознания, задержка роста и развития, анемия, судороги). Описанные в медицинской литературе 3 случая В6 авитаминоза как раз и являются примерами такой «зависимости». Они возникли у детей, матери которых принимали в течение беременности высокие дозы пиридоксина. [ Введение пиридоксина в мега-дозах (200-2000 мг/сут) может вызвать тяжелую сенсорную нейропатию – онемение кистей и стоп, появление в них чувства сдавления. ФВ: таблетки по 2, 5 и 10 мг; раствор 1 и 5% в ампулах по 1 мл. Аскорбиновая кислота (Ascorbinic acid, Vitamin C) Интересно отметить, что аскорбиновая кислота выполняет роль витамина только у приматов, морских свинок, летучих мышей-крыланов, воробьев и краснобрюхих дроздов. Все другие животные способны синтезировать эту кислоту из глюкозы. Пищевая роль. Аскорбиновая кислота содержится как в продуктах растительного, так и животного происхождения. Основными источниками витамина С являются:
МД: В организме аскорбиновая кислота превращается частично в дигидроаскорбиновую кислоту и при этом образуется окислительно-восстановительная система, которая способна переносить водород в различных биохимических реакциях. ФК: Аскорбиновую кислоту вводят внутрь, внутримышечно (лучше совместно с новокаином или лидокаином) и внутривенно. Всасывание аскорбиновой кислоты в полости рта происходит пассивно, в кишечнике – при помощи активного транспорта, сопряженного с переносом глюкозы. Если аскорбиновую кислоту вводя
Поиск по сайту: |
 В организм человека витамин А поступает в основном в виде ретинола и его эфиров с пальмитиновой кислотой. Витамин А содержится только в продуктах животного происхождения: рыбьем жире, сливочном масле и яичном желтке, печени морских рыб (треска, морской окунь) и животных (кит, морж, тюлень). Продукты растительного происхождения содержат предшественники витамина А – провитамины из группы каротиноидов (a-, b- и g-каротины). Каротиноиды находятся в моркови, салате, шпинате, петрушке, луке, щавеле, красном перце, смородине, чернике, абрикосах, персиках и др. Наиболее активным каротиноидом является b-каротин, который с химической точки зрения представляет 2 молекулы ретинола, соединенные изопреновыми радикалами. Однако, активность каротиноидов в 2-4 раза ниже, чем активность ретиноидов. Это связано с тем, что каротиноиды хуже всасываются и не полностью подвергаются трансформации в ретинол.
В организм человека витамин А поступает в основном в виде ретинола и его эфиров с пальмитиновой кислотой. Витамин А содержится только в продуктах животного происхождения: рыбьем жире, сливочном масле и яичном желтке, печени морских рыб (треска, морской окунь) и животных (кит, морж, тюлень). Продукты растительного происхождения содержат предшественники витамина А – провитамины из группы каротиноидов (a-, b- и g-каротины). Каротиноиды находятся в моркови, салате, шпинате, петрушке, луке, щавеле, красном перце, смородине, чернике, абрикосах, персиках и др. Наиболее активным каротиноидом является b-каротин, который с химической точки зрения представляет 2 молекулы ретинола, соединенные изопреновыми радикалами. Однако, активность каротиноидов в 2-4 раза ниже, чем активность ретиноидов. Это связано с тем, что каротиноиды хуже всасываются и не полностью подвергаются трансформации в ретинол.

 Изотретиноин (Isotretinoin, Roaccutan). Является 13-цис стереоизомером ретиноевой кислоты. МД: взаимодействуя с рецепторами в цитоплазме эпителиальных клеток и клеток дермы регулирует процессы их дифференцировки и созревания: снижаются размеры и активность сальных желез, уменьшается сцепление клеток между собой, это приводит к раскрытию пор и лучшему удалению кожного сала, нормализуется его состав.
Изотретиноин (Isotretinoin, Roaccutan). Является 13-цис стереоизомером ретиноевой кислоты. МД: взаимодействуя с рецепторами в цитоплазме эпителиальных клеток и клеток дермы регулирует процессы их дифференцировки и созревания: снижаются размеры и активность сальных желез, уменьшается сцепление клеток между собой, это приводит к раскрытию пор и лучшему удалению кожного сала, нормализуется его состав. Этретинат (Etretinat, Tigason). Ароматический аналог ретиноевой кислоты. МД: связывается с RXR рецепторами и нормализует процессы дифференцировки и кератинизации эпителиальных тканей, уменьшает интенсивность апоптоза.
Этретинат (Etretinat, Tigason). Ароматический аналог ретиноевой кислоты. МД: связывается с RXR рецепторами и нормализует процессы дифференцировки и кератинизации эпителиальных тканей, уменьшает интенсивность апоптоза. Витамин Е содержится в зеленых частях молодых растений, проросших злаках, растительных маслах (подсолнечном, хлопковом, кукурузном, арахисовом, соевом, облепиховом), небольшие его количества есть в яйцах и молоке.
Витамин Е содержится в зеленых частях молодых растений, проросших злаках, растительных маслах (подсолнечном, хлопковом, кукурузном, арахисовом, соевом, облепиховом), небольшие его количества есть в яйцах и молоке. ратур и окислителей, при рН > 5,0 они достаточно быстро разрушаются при автоклавировании, а при рН > 7,0 – даже при кипячении. Если рН раствора превышает 8,0 то тиамин быстро образует окрашенные в желтый цвет комплексы, которые через ряд необратимых реакций быстро утрачивают витаминную активность.
ратур и окислителей, при рН > 5,0 они достаточно быстро разрушаются при автоклавировании, а при рН > 7,0 – даже при кипячении. Если рН раствора превышает 8,0 то тиамин быстро образует окрашенные в желтый цвет комплексы, которые через ряд необратимых реакций быстро утрачивают витаминную активность. Рибофлавин (Riboflavin, Vitamin B2) Является желтым флавоновым пигментом, который содержится в молоке, яйцах, печени, зеленых листьях растений, зернах злаков. Часть рибофлавина в организме человека синтезируется флорой толстой кишки, однако не известно, способен ли всасываться этот витамин. Суточная потребность в рибофлавине составляет около 1,5-3,0 мг или приблизительно 0,4 мг на 1000 ккал пищи.
Рибофлавин (Riboflavin, Vitamin B2) Является желтым флавоновым пигментом, который содержится в молоке, яйцах, печени, зеленых листьях растений, зернах злаков. Часть рибофлавина в организме человека синтезируется флорой толстой кишки, однако не известно, способен ли всасываться этот витамин. Суточная потребность в рибофлавине составляет около 1,5-3,0 мг или приблизительно 0,4 мг на 1000 ккал пищи. Кальция пантотенат (Calcii pantothenas, Pantotene) МД: Пантотеновая кислота образована пантоевой кислотой и b-аланином. При участии витамина В6 в печени может происходить синтез пантотеновой кислоты из этих предшественников. В организме человека пантотеновая кислота присоединяет остаток b-меркаптоэтиламина и превращается в пантетеин (незаменимый фактор роста йогуртообразующих бактерий – Lactobacillus bulgaricus). После того, как пантетеин соединяется с АТФ образуется коэнзим А – активная форма витамина, с которой и связывают его биологическую активность – участие в транспорте ацетата и других ацильных групп.
Кальция пантотенат (Calcii pantothenas, Pantotene) МД: Пантотеновая кислота образована пантоевой кислотой и b-аланином. При участии витамина В6 в печени может происходить синтез пантотеновой кислоты из этих предшественников. В организме человека пантотеновая кислота присоединяет остаток b-меркаптоэтиламина и превращается в пантетеин (незаменимый фактор роста йогуртообразующих бактерий – Lactobacillus bulgaricus). После того, как пантетеин соединяется с АТФ образуется коэнзим А – активная форма витамина, с которой и связывают его биологическую активность – участие в транспорте ацетата и других ацильных групп. Суточная потребность в пантотенате составляет 10-12 мг. Наиболее богаты им маточное молочко пчел, икра тунца и трески.
Суточная потребность в пантотенате составляет 10-12 мг. Наиболее богаты им маточное молочко пчел, икра тунца и трески.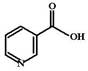 Пищевая роль. В пище свободная форма ниацина встречается в очень малых количествах. Бóльшая часть ниацина находится в составе НАД и НАДФ, а также в виде эфирных комплексов с углеводами (ниацетин) и пептидами (ниациногены), которые содержатся в злаках и имеют крайне низкую биодоступность. Наиболее важными пищевыми источниками ниацина являются мясо (печень), рыба, бобовые, некоторые орехи (арахис) и злаковые. Кофе и чай также содержат этот витамин в приемлемых количествах. При обжаривании зеленый кофейных зерен тригонеллин (1-метил-никотиновая кислота) превращается в никотиновую кислоту.
Пищевая роль. В пище свободная форма ниацина встречается в очень малых количествах. Бóльшая часть ниацина находится в составе НАД и НАДФ, а также в виде эфирных комплексов с углеводами (ниацетин) и пептидами (ниациногены), которые содержатся в злаках и имеют крайне низкую биодоступность. Наиболее важными пищевыми источниками ниацина являются мясо (печень), рыба, бобовые, некоторые орехи (арахис) и злаковые. Кофе и чай также содержат этот витамин в приемлемых количествах. При обжаривании зеленый кофейных зерен тригонеллин (1-метил-никотиновая кислота) превращается в никотиновую кислоту.
 В отличие от никотиновой кислоты не оказывает сосудорасширяющего действия, не влияет на обмен холестерина и синтез липопротеинов.
В отличие от никотиновой кислоты не оказывает сосудорасширяющего действия, не влияет на обмен холестерина и синтез липопротеинов. Пиридоксина гидрохлорид (Pyridoxine hydrochloride, Vitamin B6) Витамин В6 существует в форме 3 витамеров, отличающихся заместителями в 4-ом положении пиридинового кольца: пиридоксин (С4 гидроксиметил), пиридоксаль (С4 формил) и пиридоксамин (С4 метиламин). В печени человека эти витамеры могут переходить один в другой.
Пиридоксина гидрохлорид (Pyridoxine hydrochloride, Vitamin B6) Витамин В6 существует в форме 3 витамеров, отличающихся заместителями в 4-ом положении пиридинового кольца: пиридоксин (С4 гидроксиметил), пиридоксаль (С4 формил) и пиридоксамин (С4 метиламин). В печени человека эти витамеры могут переходить один в другой.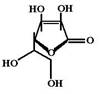 Суточная потребность в витамине С составляет 30-60 мг. Общее количество витамина С в организме составляет 1500 мг (но при чрезмерном поступлении витамина в организм его депо может увеличиваться до 2500 мг). Запасов депо хватает на 30-45 дней.
Суточная потребность в витамине С составляет 30-60 мг. Общее количество витамина С в организме составляет 1500 мг (но при чрезмерном поступлении витамина в организм его депо может увеличиваться до 2500 мг). Запасов депо хватает на 30-45 дней.