 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Улучшение состояния (день) Исчезновение желтухи (день) ⇐ ПредыдущаяСтр 5 из 5
Длительность желтушного периода (день) Нормализация размеров печени (день) Общий билирубин: При поступлении При выписке АлТ: при поступлении При выписке Через 10 дней после выписки Средний койко-день Виды терапии
17,84 ± 1,16 56,24 ± 6,27 8,55 ± 0,48 6,08 ± 0,18 1,21 ± 0,06 0,54 ± 0,02 20,07 ±1,24
При испытании препарата в качестве радиозащитного средства у больных раком легкого П-Ш стадии на фоне гипоксирадиотерапии в контрольной группе установлено статистически значимое снижение числа лейкоцитов на 25% к концу 1 этапа лечения, в исследуемой группе это снижение составило 12,7% и было статистически недостоверным. Клинические признаки общей лучевой реакции отмечались у 21% больных исследуемой группы, получавшей таурин, и у 31% контрольной группы. Установлено также, что применение препарата "таблетки таурина" способствует нормализации лимфопении, что обосновывает его применение в качестве средства симптоматической терапии, снижающей уровень общих лучевых реакций у онкологических больных (таб. 28). Таблица 28 Показатели морфологического состава периферической крови у больных раком лёгкого, получавших лучевую терапию и "таурин"
аи Эритроц Гемогло Лейкоц Лимфоцит Моноцит Сегмент СОЭ Иты бин иты ы ы оядерны мм/ч хЮ12/п г/л хЮ9/п хЮ9/п хЮ9/п ехЮ9/п 3,98+0,1 131,6+4, 5,8±0,5 1,23±0,17 0,37±0,05 3,94±0,3 33,0±4, 3 4 0 4 0 3
ГРТ 4,2±0,1 139,0±1, 4,8±0,2 0,69±0,06* 0,29±0,05 3,45±0,15 35
0 3,9±0,08 129,0±2, 5,1±0,4 0,97+0,09** 0,29±0,06 3,65±0,3 36
* — различия статистически достоверны относительно исходного уровня, ** — различия статистически достоверны относительно контрольной При испытании препарата у 30 больных раком желудка П-Ш ст. на фоне химиолучевои терапии или в предоперационном периоде ни в одном случае не отмечено реакций, связанных с приёмом препарата, он не вызывает токсических и аллергических реакций. Каких-либо изменений в течение опухолевого процесса при назначении препарата не отмечено, однако у пациентов, получавших "таблетки таурина", отмечается улучшение аппетита и уменьшение диспептических проявлений. Препарат существенно не влиял на показатели красной крови, оказывая нормализующее влияние на содержание лейкоцитов и лимфоцитов, активность аминотрансфераз и содержание билирубина, способствуя снижению концентрации мочевины в плазме крови. Кроме того, назначение препарата индуцировало увеличение количества Т-лимфоцитов, Т-хелперов, устранение дисфункции гуморального иммунитета, повышение неспецифической резистентности организма (таб. 29-35). Вышеперечисленное обосновывает применение "таблеток таурина" в онкологической практике в предоперационном периоде в качестве средства коррекции нарушений гомеостаза, связанных с нарушением функции печени и радиопротекторного средства, улучшающего течение раннего послеоперационного периода. В клинике педиатрии показано, что при применении препарата "таблетки таурина" в комплексном лечении детей (дискинезии желчевыводящих путей, гепатиты, дуоденогастральный рефлюкс) побочных реакций не было. Назначение препарата на фоне гепатитов, возникающих вследствие внутриутробного инфицирования клинического и лабораторного эффекта не выявило. Результаты применения препарата при дискинезиях желчевыводящих путей гипотонического или гипертонического типа выявили нивелирование основного компонента дискинезии, нормализацию клинико-лабораторных показателей, нормализацию самочувствия, аппетита, окраски кожных покровов, исчезновение симптомов раздражения над проекцией желчного пузыря. В комплексе стандартной терапии детей с дуодено-гастральным рефлюксом назначение таурина приводило к исчезновению тошноты, неприятных ощущений в эпигастральной области и позволило наполовину уменьшить дозу церукала. Перечисленное даёт основание рекомендовать таурин для широкого использования в клинике гастроэнтерологии при лечении функциональных нарушений. Таким образом, применение таурина в качестве гепато- и радиопротекторного средства является оправданным и целесообразным. По этим показаниям препарат был рассмотрен и рекомендован для регистрации Фармкомитетом МЗ РБ. Таблица 29 Общий анализ крови у больных раком желудка II стадии, получавших таурин в предоперационном периоде
1 - р<0,05 в сопоставлении с исходной величиной. Таблица 30 Общий анализ крови у больных раком желудка III стадии, получавших таурин в предоперационном периоде
121 1 - р<0,05 в сопоставлении с исходной величиной, Таблица 31 Биохимический анализ крови у больных раком желудка II стадии, получавших таурин
- р<0,05 в сопоставлении с исходной величиной, Таблица 31 Биохимический анализ крови у больных раком желудка III стадии, получавших Таурин
Общий белок, г/л 67.27±1.33 Мочевина, 6.21±0.72 ммоль/л Билирубин,ммоль/ 10.31±0.96 л
АлАТ, ммоль/л 0.68±0.10 АсАТ, ммоль/л 0.52±0.13 К+, ммоль/л 4.31±0.70 Na+, ммоль/л 130.12±2.10 СГ, ммоль/л 100.13±1.03 Глюкоза, ммоль/л_______ 5.65±0.19 1 - р<0,05 в сопоставлении с исходной величиной, Таблица 32 Иммунограмма больных раком желудка II стадии, получавших таурин
Сроки наблюдений 1-3 сутки после операции
Т-лимфоциты (Е-РОК), х 109/л 0.92±0.11 1.00±0.17 Т-лимфоциты (активные), % 38.3±3.2 37.2±2.9 Т-лимфоциты (активные), х 0.52±0.06 0.59±0.10 109/л Т-РОК 5.65±1.46 3.25±0.84 теофиллинчувствительные, % Т-РОК теофиллинрезистентные, 62.2±2.7 58.1±3.8 7-10 сутки после операции 62.5±3.5 1.13±0.16 44.5±6.3 0.74±0.091 3.90±0.98 63.0±3.2
1 - р<0,05 в сопоставлении с исходной величиной, 2 - р<0,05 в сопоставлении с показателем на 1-3 сутки после операции, Таблица 33 Иммунограмма больных раком желудка III стадии, получавших таурин
Сроки наблюдений при 1-3 сутки 7-10 сутки поступлении после после операции операции
Таблица 34 Коагулограмма больных раком желудка II стадии, получавших таурин
1 - р<0,05 в сопоставлении с исходной величиной Таблица 35 Коагулограмма больных раком желудка III стадии, получавших таурин
1 - р<0,05 в сопоставлении с исходной величиной На основании анализа литературных данных, обосновывающих антиатерогенные свойства Таи, результатов, полученных нами в модельной ситуации атеросклероза (глава 3.1), а также при исследовании процессов формирования аминокислотного фонда в плазме крови больных облитерирующим атеросклерозом нижних конечностей (ОАСНК) (снижение концентрации Таи и обеднение фонда свободных серусодержащих аминокислот в плазме крови и тканях экспериментальных животных и больных) [27, 95, 96,110, 206, 207], в качестве патологии для расширения показаний к применению таурина в клинике мы исследовали возможность коррекции этим соединением аминокислотного дисбаланса при ОАСНК. Таи применялся на фоне традиционного лечения 30 больных ОАСНК III-IV стадии в виде обогащенной этим соединением (4г на ЮОг сухой смеси) питательной смеси "Тонус-1" ("Беллакт", г. Волковыск) по 1 десертной ложке 3 раза в день, в течение 3 недель. Назначение обогащенной Таи питательной смеси приводило к нормализации уровней серусодержащих, гликогенных аминокислот (рис. 28), а также АРУЦ в плазме крови больных ОАСНК II-IV стадии, что свидетельствует об активации процессов синтеза и транспорта серусодержащих соединений, глюконеогенеза [10]. Концентрации ароматических аминокислот оставались сниженными (рис. 28). Таким образом, основным результатом применения таурина в виде компонента лечебного питания при ОАСНК является достигнутая нами коррекция фонда серусодержащих аминокислот, а также тенденция к нормализации содержания гликогенных аминокислот и АРУЦ, а полученные результаты обосновывают целесообразность включения питательной смеси "Тонус-1" в схему лечения больных ОАСНК в III-IV стадии заболевания. Рис. 28. Содержание свободных аминокислот в плазме крови больных ОАСНК III-IV стадии при назначении обогащенной Таи питательной смеси "Тонус-1"
Кроме того, нами для коррекции аминокислотного и метаболичемского дисбаланса в целом у больных ОАСНК II стадии (30 человек) на фоне традиционного лечения назначался препарат "таблетки таурина" (0,5x3 раза в день, 21 день). Применение препарата на фоне традиционной терапии ОАСНК уже в середине лечения индуцировало увеличение его концентрации до контрольных значений. Содержание цистеиновой кислоты при оставалось повышенным, а уровни аспартата, серина и этаноламина в середине лечения практически нормализовались. Препарат не оказал влияния на содержание в плазме крови больных ОАСНК метионина, однако нормализовал концентрацию цистина (рис.29). Таким образом, препарат, очевидно, способен включать цепь метаболических превращений метионина, активируя поток серусодержащих аминокислот и способствует ликвидации существующего аминокислотного дисбаланса в плазме крови больных ОАСНК. Кроме того, назначение препарата способствует улучшению объективного статуса, сокращению сроков пребывания больных в стационаре и снижению процента ампутации конечностей [110]. На основании проведенных исследований нами обоснована необходимость заместительной терапии и целенаправленной метаболической коррекции аминокислотного дисбаланса, формирующегося при ОАСНК, прераратом "таблетки таурина".
Рис. 29. Содержание свободных аминокислот в плазме крови у больных ОАСНК II стадии (контроль, поступление, середина лечения, выписка) на фоне применения таурина, мкМ Столбцы с обводкой: р<0,05 по отношению к значениям при поступлении
Рис.30. Содержание биогенных аминов и их метаболитов в плазме крови у больных ОАСНК II стадии (контроль, поступление, середина лечения, выписка) на фоне применения таурина. Тгр - мкмоль/л, остальные (кроме отношения NE/E) - нмоль/л Столбцы с обводкой: р<0,05 по отношению к значениям при поступлении
Проведенное нами ранее исследование закономерностей формирования аминокислотного фонда печени, плазмы крови и желчи пациентов на фоне функционально-обратимых поражений гепатобилиарной системы при острых и хронических холециститах показало, что как острая, так и хроническая форма холецистита сопровождается гипераминоацидемией в основном за счет гликогенных, ароматических и серосодержащих аминокислот, а также аминокислот и их производных — маркёров антитоксической функции печени (мочевина, аммиак, а-аминобутират) [10]. Сдвиги в содержании указанных соединений более выражены при хронической форме заболевания, особенно - за счёт увеличения суммарного фрнда серосодержащих аминокислот. В дальнейшем на фоне развившейся печёночной недостаточности у 147 больных с подпечёночной желтухой на этапах оперативного устранения желчной гипертензии нами были исследованы закономерности формирования аминокислотного пула. Аминокислотный дисбаланс в плазме крови этой группы больных характеризуется гипераминоацидемией в равной степени как за счет ЗА, так и НА, резким снижением концентрации АРУЦ и уменьшением отношения АРУЦ/ААК. Характерным для плазмы крови является резкое увеличение концентрации серосодержащих аминокислот или образующих парные соединения с желчными кислотами аминокислот (глицин). Изменения в содержании исследуемых соединений в печени на фоне ее недостаточности в целом свидетельствуют об ингибировании реакций синтеза аминокислот в печени, поступления их в желчь и снижении активности процессов энтерогепатической рециркуляции [10,14,16]. Тем самым внепечёночный холестаз на фоне развивающейся печёночной недостаточности характеризуется выраженным аминокислотным дисбалансом, который формируется главным образом за счет изменения уровня гликогенных и серосодержащих аминокислот. Линейно-дискриминантный анализ аминокислотного фонда биоптатов печени этих больных показал, что, несмотря на имеющееся повышение содержания его предшественников, уровень таурина практически не отличается от контрольных цифр. Очевидно, что в такой ситуации увеличение концентрации таурина в печени может быть достигнуто только за счёт его экзогенного введения. Математическое моделирование процессов формирования фонда свободных аминокислот в печени обосновывает целесообразность дополнительного экзогенного введения таурина при гепатобилиарной патологии [10]. Таким образом, на фоне функционально-обратимых или морфологических изменений в печени при гепатобилиарной патологии у людей формируется качественно сходные метаболические нарушения, приводящие к аминокислотному дисбалансу и увеличению концентрации серосодержащих, ароматических и гликогенных аминокислот в печени и плазме крови. На основании полученных результатов нами обоснована целесообразность мониторинга аминокислотного фонда и эффективность применения аминозолей, обогащенных серосодержащими аминокислотами или таурином для нормализации аминокислотного дисбаланса, функционального состояния печени в целях диагностики и лечения начальных стадий ее поражения. Одновременно, введение в желчные протоки 60мл 4% раствора таурина ("Тауфон"), растворённого в 500 мл изотонического раствора хлорида натрия под давлением 140 - 180 мм водного столба с первых суток после наложения лапароскопической холецистостомы приводит к контролируемой декомпрессии, коррекции аминокислотного дисбаланса и существенному уменьшению проявлений печёночной недостаточности и клинико-биохимических показателей, а также снижает частоту послеоперационных осложнений и сроки пребывания больных в стационаре [14]. Учитывая известные и продемонстрированные нами в эксперименте (глава 3) свойства Таи в качестве соединения, способствувствующего ликвидации аминокислотного дисбаланса и обладающего эффектами тормозного нейромодулятора [208], а также на основании результатов исследования спектра свободных аминокислот и их дериватов в плазме крови больных остеохондрозом (обеднение фонда серусодержащих аминкислот и снижение концентрации Таи в плазме крови) [209] нами для расширения показаний применения препарата таблетки таурина в клинике проведены клинические испытания по его применению для терапии дегенеративно-дистрофических процессов у больных с неврологическими проявлениями остеохондроза (1 таб 3 раза в день, 21 день). Физиологическими критериями эффективности препарата у данной категории больных на фоне болевого синдромома являлись улучшение биоэлектрической активности скелетных мышц спины и нижних конечностей, позитивная динамика амплитуды и частоты электромиограммы и увеличение фона активных двигательных единиц. По нашим данным [208], у больных, получавших препарат "таблетки таурина" в сравнении с лечившимися без него наблюдалось ослабление выраженности болевого синдрома, нормализация тонуса скелетных мышц и увеличение объема активных движений. Кроме того, назначение таблетированного таурина индуцировало процессы, направленные на нормализацию уровня эндогенного таурина и цистеина в плазме крови больных. На этом основании нами обоснована целесообразность сочетанного применения мануальной терапии и метаболической коррекции таурином при болевом синдроме, обусловленном остеохондрозом позвоночника, которое вследствие нормализации электрофизиологических и метаболических процессов в опорно-двигательном аппарате создает предпосылки для стойкой ремиссии [208]. ГЛАВА 5. МЕХАНИЗМЫ РЕГУЛЯТОРНЫХ ЭФФЕКТОВ И СТРАТЕГИЯ ИСПОЛЬЗОВАНИЯ L-АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ В КАЧЕСТВЕ ЭФФЕКТИВНЫХ СРЕДСТВ МЕТАБОЛИЧЕСКОЙ ТЕРАПИИ И НОВЫХ ЛЕКАРСТВЕННЫХ
Известно, что свободные аминокислоты и их производные являются одними из наиболее универсальных природных регуляторов и эндогенных модификаторов биологических реакций [210], поскольку: 1. in vivo они представлены широким спектром родственных по химической 2. транспорт, промежуточный обмен, синтез и утилизация этих соединений 3. их уровни являются важнейшими регулирующими факторами процессов На сегодняшний день существует более чем достаточно доказательств в пользу того, что аминокислоты относятся к соединениям, на основе которых могут быть разработаны новые эффективные лекарственные препараты направленного метаболического действия [213]. Фармацевтические отрасли промышленности большинства высокоразвитых стран в настоящее время уже активно "эксплуатируют" высокоочищенные L-аминокислоты не только в качестве полноценных пищевых добавок, но и субстанций для производства широкого спектра жизненно важных лекарственных препаратов [215, 216]. При этом подавляющее большинство современных технологий производства аминокислот разработаны в Японии, а производство лекарств на их основе сконцентрировано в Германии, Финляндии, Японии, Швеции и США, где, по мнению экспертов в области Фарминдустрии, в последние годы происходит "аминокислотная революция" [17,135,140]. Поэтому в фундаментальном и прикладном аспектах, очевидно, что сегодня наиболее актуальным и оправданным является теоретическое обоснование и экспериментальное исследование новых эффектов и механизмов действия аминокислот и родственных соединений, а также их клиническая апробация. Сегодня при имеющихся в Беларуси приоритетных разработках в этой области, обосновывающих возможность и рациональность применения L-аминокислот для метаболической терапии и направленной коррекции обмена веществ в качестве новых лекарственных средств. Так, в соответствии с заданиями Государственной научно-технической программы 43.01.р. "Создать новые эффективные лекарственные препараты на основе аминокислот и их производных" эти соединения составляют основу производства Гродненского завода медпрепаратов, на котором к 2010г. запланирован выпуск "полных", т.е. состоящих из 18-20 аминокислот, смесей для парентерального питания и в качестве кровезаменителей. Сложность этой задачи связана с тем, что требуется одновременное освоение производства большого количества субстанций L-аминокислот, условия синтеза и химико-фармацевтические требования к которым носят совершенно различный характер. Для каждой из субстанций требуется прохождение полного цикла доклинических и клинических испытаний, т.е. огромный объем исследовательской работы, результаты которой должны удовлетворять жестким международным стандартам. Однако, разработка «полных» аминокислотных смесей для парентерального питания далеко не исчерпывает всех перспектив медицинского применения аминокислот. Существует принципиально иной подход к стратегии применения этого класса соединений, заключающийся в целенаправленной коррекции нарушенного при определенном заболевании обмена веществ с помощью специализированных смесей нескольких аминокислот или даже отдельных соединений. Именно в этом направлении разработки белорусских ученых являются в наибольшей степени приоритетными на мировом уровне [10, 29, 212]. В настоящее время многочисленные биологические свойства L-аминокислот на практике пока что эксплуатируются главным образом с позиций восполнения дефицита или реализации их неспецифических эффектов. "Полные" растворы аминокислот для парентерального питания, содержащие кроме их высокоочищенных субстанций энергетические субстраты, витамины и микроэлементы, относительно стандартизированы по своему составу и применяются в клинической практике для заместительной терапии или парентерального питания. Разработаны и используются десятки разновидностей таких смесей для применения в педиатрической и хирургической практике [10,16,51,132,133,211,215-219]. Одновременно, незаменимые L-аминокислоты, витамины и микроэлементы включаются также в состав энтеральных лекарственных препаратов для терапии печёночной, почечной недостаточности или назначаются на фоне неспецифического адаптационного синдрома (стресса), когда имеется дефицит незаменимых нутриентных факторов. Этот, первый уровень, самый простой и распространенный, чаще всего эксплуатируется в клинической практике [215-217]. Кроме того, известно, что большинство L-аминокислот при их введении в организм в более высоких дозах, чем они поступают в организм с пищей, вызывают определенные специфические (фармакологические) эффекты. В настоящее время созданы или находятся в стадии разработки многочисленные лекарственные препараты на основе отдельных аминокислот, "эксплуатирующих" их фармакологическую активность, включающую обычно эффекты активации окислительно-восстановительных процессов, реакций энергетического обмена, обезвреживания ксенобиотиков. В первую очередь это относится к препаратам на основе отдельных L-аминокислот (метионин, глутаминовая, аспарагиновая), а также к их смесям или комплексам с витаминами и микроэлементами (глутамевит, аспаркам, панангин), которые в целом активируют обменные процессы и применяются при заболеваниях гепатобилиарной и сердечно-сосудистой систем, различного рода интоксикациях и психоневрологических расстройствах (орницетил и орнитин-аспартат, фалькамин-форте, лобамин-цистеин, S-аденозилметионин, глицин, реэргин). Этот второй уровень активно исследуется и чаще всего эксплуатируется клиническими фармакологами, гепатологами и кардиологами [16,142, 215-216]. Однако на уровне использования отдельных L-аминокислот или их композиций для восполнения дефицита или реализации прямых фармакологических эффектов практически не учитывается регуляторное действие этих соединений на метаболические процессы и ключевые реакции обмена веществ. Под регуляторным действием понимают действие аминокислот на метаболические процессы и жизненно важные функции, которое проявляется при естественных или близких к ним концентрациях этих соединений в физиологических жидкостях и тканях [10,17]. Получить регуляторный эффект от введения L-аминокислот можно, применяя либо отдельные L-аминокислоты, либо сочетания их небольшого набора, в химически чистом виде. Очевидно, что эффективное использование L-аминокислот или их производных для метаболической коррекции и направленного изменения обмена веществ при патологических или экстремальных состояниях ограничивается накопленными сведениями о механизмах регуляторных эффектов этих соединений, исследованных при концентрациях, сопоставимых с их естественным уровнем. Па протяжении последнего десятилетия в Институте биохимии ПАП Беларуси разрабатывается собственная стратегия применения L-аминокислот в качестве лекарственных препаратов, которая заключается в направленном воздействии на компенсаторно-приспособительные реакции организма, изменяющиеся при конкретных заболеваниях, за счёт влияния этих соединений на механизмы регуляции обмена веществ. Такой подход позволяет в полной мере реализовать их свойства в качестве биологически активных регуляторов и разработать на этой основе новые эффективные лекарственные препараты, которым свойственны практически полное отсутствие побочных эффектов, возможность длительного приёма, усиления полезных эффектов других лекарственных препаратов и препятствие проявлению их побочного действия, а также адаптогенные эффекты в отношении вредных факторов окружающей среды. Это третий уровень эксплуатации биологических свойств аминокислот. Указанная стратегия уже нашла подтверждение своей правильности в результатах клинических испытаний новых лекарственных препаратов гепато - и радиопротекторного ("Таурин"), иммуномодуляторного и иммунокорректорного ("лейцин") действия, исследований специфической активности новых лекарственных препаратов противоопухолевого ("деглутам"), нейроэффекторного, антиоксидантного и радиопротекторного ("тавамин"), антинаркотического и снотворного ("триптофан") действия [10,17, 29]. При таком подходе к применению L-аминокислот их дозы, как правило, значительно ниже, чем при их традиционном применении. Это позволяет разрабатывать сравнительно дешёвые препараты и схемы лечения. Кроме этого, производство препаратов направленного действия на основе отдельных аминокислот или обоснованного сочетания нескольких соединений может быть организовано значительно раньше, чем будет завершен цикл доклинических и клинических испытаний всех субстанций аминокислот, необходимых для создания «полных» аминокислотных смесей для парентерального питания. Поэтому экономически оправданным подходом к выполнению вышеуказанной Программы являются исследования с целью разработки и апробации таблетированных и инъекционных лекарственных препаратов на основе уже сегодня реально имеющихся у нас в стране высокоочищенных L-аминокислот: не дожидаясь многолетних дорогостоящих разработок их "полных" смесей, такой подход позволит уже в самое ближайшее время обеспечить Республику Беларусь высокоочищенными субстанциями и лекарственными препаратами на основе L-аминокислот, а также возможность их экспорта. Это позволит в определённой степени уменьшить степень валютной нагрузки на Республику в результате частичной замены импортируемых лекарственных препаратов различных групп, в том числе — жизненно важных, или приобретать их в результате реализации высокоочищенных субстанций аминокислот. При этом мы считаем, что наиболее оптимальной схемой является следующая последовательная трехступенчатая система замещения импорта на основе развития производства индивидуальных L-аминокислот и их композиций в Республике Беларусь, этапы которой взаимосвязаны и последовательно дополняют друг друга. Сознавая возможную субъективность своих взглядов, можно предположить, что отечественное производство лекарств на основе аминокислот на Гродненском заводе медпрепаратов позволит частично отказаться от импорта следующих групп лекарственных препаратов, или импортировать последние за счёт экспорта препаратов на основе аминокислот: I. пищевых добавок, без которых в настоящее время не обходится II. энтеральных лекарственных препаратов [215-221] для терапии: • злокачественных новообразований и иммунодефицита — • печёночной, почечной недостаточности — гепамерц, фалькамин и • адаптационного синдрома, стрессовых и астенических состояний — • заболеваний сердечно-сосудистой системы — аспаркам, глицин, • интоксикаций — метионин, цистеин, глутаминовая, аспарагиновая • поражений центральной нервной системы, психоневрологических • лучевых поражений — орницетил (Франция), фалькамин-форте, • препаратов различных групп, которые в определенной степени 1. снотворные и седативные средства; 2.протиэпилептические и противосудорожные препараты; 3. анти депрессанты; 4.противоаритмические, гипотензивные, антитромботические препараты и средства для лечения атеросклероза, коронарной и цереброваскулярной недостаточности; 5.антациды и противоязвенные препараты; б.препараты для терапии импотенции у мужчин и усиливающие оргазм у женщин; III. "полных" аминокислотных смесей для внутривенного введения — крове- и плазмозамещающие инфузионные растворы и средства для парентерального питания (аминозоли, содержащие сбалансированный набор L-аминокислот) — "Инфезол", "Аминостерил - гепа", "Аминостерил - нефро", " Аминостерил - пед", "Кетостерил", "Аминостерил - травма", "Аминоплазмаль", "Аминосол", (фирмы "Фрезениус", "Берлин-Хеми", Германия), "Вамин", "Вамин - Н" (фирма "Каби-Витрум", Швеция) [215-221]. На протяжении последних 15 лет в Институте биохимии НАНБ и на базе клиник ГГМИ проведены исследования аминокислотного фонда в биологических средах (плазма и форменные элементы крови, спинномозговая жидкость, моча, биоптаты неизмененных и опухолевых тканей) практически здоровых людей, пациентов с поражениями печени различной этиологии, злокачественными новообразованиями, неврологическими расстройствами и сердечно-сосудистой патологией (всего более 6300 случаев) Анализ результатов проведенных исследований позволяет заключить, что их уровень в физиологических жидкостях является одним из интегральных показателей обмена веществ, обосновывает применение отдельных L-аминокислот или их сочетаний для целенаправленной коррекции обмена веществ при конкретных заболеваниях и, таким образом, расширяет область практического использования этих соединений [10,17, 29, 96,136, 212, 221-229]. Так, как уже было указано выше нами доказано, что кроме известных свойств антиоксиданта, радиопротектора, нейромодулятора и стабилизатора клеточных мембран Таи способен активировать энергопродукцию, а также нормализовать обменные процессы в центральной нервной системе. При этом дополнительное включение в рацион питания больных атеросклерозом сосудов нижних конечностей смеси "Тонус-1", обогащенной таурином, позволило добиться относительной нормализации важнейших клинико-лабораторных показателей, а применение таблеток таурина в качестве лекарственного средства оказалось эффективным для улучшения объективного статуса больных с печёночной недостаточностью и в предоперационной подготовке онкологических больных на фоне лучевой терапии, увеличивая шансы на успех оперативного вмешательства и повышая её переносимость. Таким образом, полученные нами данные, с одной стороны, позволили рекомендовать Таи для включения в состав пищевых продуктов, искусственных смесей для энтерального и парентерального питания, а с другой — в качестве средства лечения гепатобилиарной патологии и в предоперационной подготовке хирургических больных и зарегистрировать его как новый лекарственный препарат (глава 4). На основании полученных в эксперименте результатов о гепатопротекторном и иммуноактивирующем действии аминокислоты L-лейцина [230], нами впервые доказана его способность активировать отдельные звенья клеточного и гуморального иммунитета как у практически здоровых людей, так и на фоне вторичного иммунодефицита при онкологических заболеваниях. Результаты, полученные в результате клинических испытаний препарата "таблетки лейцина" у 299 больных с различными видами злокачественных заболеваний, кроме того, обосновывают целесообразность его применения для профилактики послеоперационных осложнений при оперативном или комбинированном лечении указанных больных [226]. В 1999г. по этим показаниям таблетки лейцина также зарегистрированы МЗ РБ как новый лекарственный препарат. Несомненно наличие регуляторных свойств и у аминокислоты L-глутамина [6, 224]. Так, например, показано, что он является незаменимым фактором роста злокачественных опухолей и поэтому избирательно накапливается в опухолевых тканях, что приводит к его дефициту в организме больного. Одновременно, производные L- глутамина, получившие название "антинеопластоны", обладают выраженным противоопухолевым действием [224, 231]. Это направление исследований, как перспективное в области природной, нетоксической химиотерапии злокачественных опухолей, активно развивается в 90-х годах в США и Японии [232]. Нами впервые установлено, что противоопухолевый эффект производных L-глутамина зависит не только от дозы и способа их введения, но в первую очередь определяется уровнем самого глутамина в опухоли и организме больного. Результаты этих исследований позволили нам разработать оригинальную лекарственную форму нового эффективного противоопухолевого препарата «деглутам», который может назначаться в качестве средства профилактики рецидивов после радикального лечения злокачественных новообразований или для снижения активности процессов метастазирования [223, 233]. Одновременно L-глутамин является одним из важнейших соединений в центральной нервной системе [136, 6,142]. Продемонстрировано, что его назначение оказывается эффективным при состояниях, сопровождающихся сочетанными поражениями печени и головного мозга (например, при алкоголизме) [5]. В этой связи очевидна необходимость более детального исследования лечебных эффектов этого соединения. Недостаточно исследованными являются также эффекты аминокислоты триптофана. Так, за рубежом на протяжении последних лет неоднократно делались попытки применять его как безвредное снотворное средство, однако, в силу трудно предсказуемых побочных эффектов применение этого соединения ограничено [234]. Эти побочные эффекты связывают с наличием примесей, образующихся в процессе микробного синтеза триптофана. В связи с разработкой в ИФОХ НАН Беларуси новых экстракционной технологий очистки аминокислот появилась возможность получить препарат, свободный от таких побочных эффектов. Одновременно, собственные и литературные данные позволяют использовать L-триптофан в сочетании с L-лейцином, L-валином, L-изолейцином и Таи при поражениях печени. В эксперименте нам удалось дополнить эффекты триптофана при алкогольной и наркотической зависимости уже известным лечебным действием указанных аминокислот с разветвлённой углеводородной цепью [235]. В связи с этим актуальным является исследование механизмов регуляторного действия таких композиций L-аминокислот, которые, по нашему замыслу, позволят эффективно реализовать регуляторное действие входящих в их состав компонентов. В состав таких композиций в определённых соотношениях могут входить практически любые L-аминокислоты, их структурные аналоги или производные с известным механизмом действия. Имеются лишь единичные исследования регуляторных эффектов композиций L-аминокислот, но они уже позволяют обосновать их перспективность. Так, в последние годы нами разрабатывается концепция [10,14,17,29,212], обосновывающая применение оригинальных аминокислотных композиций направленного действия (миниаминозолей) с целью нормализации обмена веществ при поражениях печени, онкологических заболеваниях, вторичных иммунодефицитных состояниях и неврологических расстройствах, алкоголизме и наркоманиях, а также в пред- и послеоперационном периодах, при этом не исключая их использования в качестве пищевых добавок. В рамках этой концепции нами разработана оригинальная композиция аминокислот ("тавамин"), которая обладает выраженным гепатопротекторным действием, и, кроме того, способна устранять нарушения деятельности центральной нервной системы при поражениях печени [236]. Таким образом, литературные данные и собственные результаты свидетельствуют об актуальности такого рода направления научно-исследовательских работ и практической значимости его реализации, стратегически обосновывают проводимые и планируемые нами исследования. ЛИТЕРАТУРА 1. Таурин (фармакологические и противолучевые свойства) /Ярцев Е.И., Гольдберг Е.Д., Коменников Ю.А. — М.: Медицина, 1975. — 158с. 2. Azuoma I., Halliwell В., Наеу В.М. The antioxidant action of taurine, hypotaurine and their precursors //Biochem.J. — 1988. — V.256, N.I. — P.251-255. 3. Hayes K.C., Sturman J.A. Taurine in metabolism //Ann. Rev. Nutr. — 1981. — V. 1. —P.401-425. 4.1 lux table R.J. Physiological action of taurine //Physiol. Rev. —1992. —V.72. — P.101-163. 5. Гуревич B.C. Таурин и функция возбудимых клеток. — Л.: Наука, 1986. — 108с. 6. Раевский К.С., Георгиев В.П. Медиаторные аминокислоты — М.: Медицина, 1986. — 240с. 7. Dorvil N.P., Yousef I.M., Tuchweber В. Taurine prevents cholestasis induced by lithocholic acid sulfate in gunea pigs //Amer. J. Clin. Nutr. —1983. — V.37, N.2. — P.221-232. 8. Nakashima Т., Seto Y., Toshikazu N., Shima Т., Iwai Y., Zeizo K., Okanque Т., Kashima K. Calcium-associated cytoprotective effect of taurine on the calcium and oxygen paradoxes in isoleted rat hepatocytes //Liver —1990. — V.10. —P.167-172. 9. Naskalski J.W. Myeloperoxidase inactivation in the course of catalysis of chlorination of taurine //Biochem. Biophys. Acta. — 1977. — V.485. — P.291-300. 10. Нефёдов Л.И. Формирование фонда свободных аминокислот и их производных в условиях метаболического дисбаланса: Автореф. дисс... д-ра медицинских наук. — Минск, 1993,34 с. 11. Gentile S., Bologna E., Terracina D., Angelico M. Taurine-induced diuresis and natriuresis in cirrhotic patients with ascites //Life Sci. —1994. — V.54, N.21, —P.1585-1593. 12. Wang W. Y., Liaw K.Y. Effect of a taurine-supplemented diet on conjugeted bile acids in biliary surgical patients //J. Parenter. Enteral. Nutr. — 1991. — V.15, N.3. — P.294-297. 13. Yamamoto S., Ohmoto K., Ideguchi S. Yamamoto R., Mitsui Y., Shimabara M., Iguchi Y., Ohumi Т., Takatori K. Painful muscle cramps in liver cirrhosis and effects of oral taurine administration //Nippon Shokakibyo Gakkai Zasshi. — 1994. — V.91, N.7. — P.1205-1209. 14. Маслакова Н.Д., Нефёдов Л.И. Аминокислоты и их производные в патогенезе и лечении поражений панкреатогепатобилиарной системы (учебно-методические рекомендации) Гродно, ГГМИ, 1998, 21с. 15. Нефёдов Л.И. Проявления биологической активности таурина //Весщ АН Беларуси сер. биол. наук. 1992. №3-4. С.99 - 106. 16. Нефёдов Л.И., Маслакова Н.Д., Цыркунов В.М. и др. //Becui АН Беларуси, сер. хим. наук. 1997. №2. С. 39-46 17. Нефёдов Л.И., Угляница К.Н., Солдатов B.C. и др. Механизмы регуляции метаболического баланса: результаты и перспективы применения аминокислот и их композиций в качестве универсальных биологически активных природных регуляторов направленного действия и эффективных лекарственных препаратов //Весщ НАН Б (сер. биол. наук), 1998, N 4, с. 62-70. 18. Azuoma J., Sawamura A., Awata N. Usefulness of taurine in chronic congestive heart failure and its prospective application //J. Circ. J. — 1992. — V.56, N.I. — P.95-99. 19. Remme W.J. Congestive heart failure. Drug therapy: central or peripheral approach? //Cardiolagia. —1993. — V. 38, N.12, Suppl.1. — P.51-59. 20. Sato Y., Ogata E., Fujita T. Hypotensive action of taurine in DOCA-salt rats — involvement of sympathoadrenal inhibition and endogenous opiate //Jpn. Circ. J. — 1991. — V.55, N.5. — P.500-508. 21. Tenaglia A., Cody R. Evidence for taurine-defeciency cardiomyopathy //Am. J. Cardiol. — 1988. — V.62. — P.136-139. 22. Нефёдов Л.И., Климович И.И., Смирнов В.Ю. Механизмы реализации кардиопротекторного действия таурина: влияние на формирование фонда свободных аминокислот и их производных в миокарде //Хирургия аорты и её ветвей: тезисы II республиканской конференции сердечно-сосудистых хирургов 21-22 ноября.-Минск: 1996.-С.78-79. 23. Поздеев В.К. Медиаторные процессы и эпилепсия. — Л.: Наука, 1983. — 112с. 24. Поздеев В.К. Метаболическая терапия эпилепсии. — Псков: Стерх, 1995. — 140с. 25. Oja S.S., Korpi E.R. Amino acid transport //Hand. Neurochem. — N.Y., 1983. —P.311-337 26. Методические указания о препаратах и лекарственных формах, рассмотренных фармакологическим комитетом в январе-апреле. -М., 1976. - С 6. 27. Климович И.И., Нефёдов Л.И., Радилович В.М. Коррекция аминокислотного дисбаланса при облитерирующем атеросклерозе на фоне сахарного диабета /Я Белорусский Международный конгресс хирургов 10-13 декабря.-Витебск: 1996.-С.405-406. 28. Borodynsky A.N., Nefyodov L.I., Ostrovsky S.Yu. Effect of BCAA and taurine on the carbohydrate metabolism in the liver of rat with alcohol abstinent syndrome: Proc of 7th Congress of ESBRA, Barselona, 16-19 June, 1999, p.458. 29. Нефёдов Л.И., Курбат Н.М., Угляница К.Н. и др. Специализированные смеси аминокислот для энтерального и парентерального питания //Национальная политика в области здорового питания в республике Беларусь: Материалы международной конференции, 20-21 ноября, 1997, Минск. — С. 74-76. 30. Шейбак Л.Н., Нефёдов Л.И., Шейбак М.П. Значение таурина для растущего организма: Росссийский Вестник перинатологии и педиатрии, 1995, т.40, №5, с. 48-52. 31. Нефёдов Л.И. и др. Способ коррекции ранней адаптации новорожденных детей:, Патент РБ, а. 1998, 0768,14.08.1998. 32. Отчёт по доклиническим исследованиям высокоочищенной субстанции 2-аминоэтансульфоновой кислоты и её готовой лекарственной формы "таблетки таурина", 1996, Мн., ЦГР НИОКР, 111с. 33. Холодов Л.Е., Яковлев В.П. Клиническая фармакокинетика. - М., Ме- дицина. -1985. 34. Jacobsen J.G. Taurine: Occurence biosynthesis, metabolic fate and physiological role in mammals. — Kobenhaum: Nyt. Nord. Torlag, 1968. — p.150. 35. The role of amino acids in the brain /Quastel J.H., Marks V., Lajtha A., et al. — London. — N.Y.: Raven Press, 1979. — p.298. 36. Sturman J.A., Hayes K.C. The biology of taurine in nutrition and development //Adv. Nutr. — 1980. — V.4. — P.231-299. 37. Stipanuk M., Rotter M.A. Metabolism of cysteine, cysteinsulfinate and cysteinsulfonate in rats fed adequate containing amino acids //J. Nutr. — 1984. — V.114, N.8. — P.1426-1437. 38. Wright C.E., Tallan H.H., Lin Y.Y. Taurine: biological update //Ann. Rev. Biochem. — 1986. — V.55. — P.427-453. 39. Taurine / Ed. Huxtable R., Barbeau A. — N.Y.: Raven Press, 1976. — p.398. 40. Sturman J.A. Metabolism of S-taurine in man 113. Nutr. — 1975. — V.105. — P.1206-1214. 41. Timbrell J.A., Seabra V., Waterfield C.J. The in vivo and in vitro protective propeties of taurine //Gen. Pharmac. —1995. — V.26., N.3. — P.453-462. 42. Kuo S.M., Lea T.C., Stipanuk M.H. Development pattern, tissue distribution and subcellular distribution of cysteine: oc-ketoglutarate aminotransferase and 3-mercaptopyruvate sulfurtransferase activities in the rat //Biol. Neonate. —1983. — V.43. — P.23-32. 43. Matchews R.G., Jencks D.A., Fraska V. Methionine biosynthesis //Chem. and Biol. Pteridines. — Berlin, 1986. — P.697-707. 44. Ubuka Т., Umemura S., Ishimoto Y. Transamination of L-cysteine in rat liver mitochondria //Physiol. Amer. and Physics. — 1977. — V.9. — P.91-96. 45. Ubuka Т., Yusa S., Ishimoto Y. Desulfuration of L-cysteine through transamination and transsulfuration in rat liver //Physiol. Chem. and Physic. — 1977. — V.9. — P.241-252. 46. Ishimoto Y. Transaminative pathways of cysteine metabolism in rat tissues //Physiol. Chem. — 1979. — V. 11, N.l-2. — P.189-191. 47. Wienstein C.L., Haschemeyer R.H., Griffith O.W. In vivo study of cysteine metabolism 113. Biol. Chem. — 1988. — V.263, N.22. — P.16568-16579. 48. Dupre S., Spoto G., Solinas S.P. Cysteine as precursor and sulfur donor in the biosynthesis of natural sulfur containinig compounds //Sulfur Amino Acids: Biochemical Aspects / Ed. A.R. Liss. — N.Y., 1983. — P.343-353. 49. Hosokawa K. Immaturity of the enzyme activity and the response to induced of rat liver cysteine dioxygenase during development 113. Biochem. — 1980. — V. 88. — P.389-394. 50. Lambardini J.B., Singer T.P., Boyer P.D. Cysteine oxydase 113. Biol. Chem. — 1969. — V.244, N.5. — P.1172-1175. 51. Cooper A.J.L. Role of the liver in amino acids metabolism //Hepatology: a textbook f liver disease. Vol.1. — Philadelphia, London etc. —1996. — p.563-600. 52. Bender D.A. Amino acid metabolism. — N.Y.: J. Willey & Sons, 1975. — p.234. 53. Misra C.H. In vitro study cysteine oxidase in rat brain //Neurochem. Res. — 1983. — V.8, N.ll. — P.1496-1508. 54. Yamagushi K., Sasakibara S., Asamuru J. Induction and activation of cysteine oxidase in rat liver. The measurment of cysteine metabolism in vivo and the activation f cysteine oxidase //Biochem. Biophys. Acta. — 1973. — V.297. — P.48-59. 55. Griffith O.W. Cysteinsulfinate metabolism //J. Biol. Chem. —1983. — V.258, N.3. — P.1591-1598. 56
Поиск по сайту: |
 Базисная терапия + "таурин" 9,87 ± 1,03 7,42 ± 0,59 8,76 ±0,73
Базисная терапия + "таурин" 9,87 ± 1,03 7,42 ± 0,59 8,76 ±0,73 Динамика биохимических показателей у больных гепатитом, получавших препарат, была более положительной: через 10 дней после выписки из стационара активность АлАТ, в отличии от контрольной группы, полностью нормализовалась. Всё перечисленное предполагает, что препарат "таблетки таурина" может быть использован в качестве базисного гепатопротекторного средства в лечении гепатита.
Динамика биохимических показателей у больных гепатитом, получавших препарат, была более положительной: через 10 дней после выписки из стационара активность АлАТ, в отличии от контрольной группы, полностью нормализовалась. Всё перечисленное предполагает, что препарат "таблетки таурина" может быть использован в качестве базисного гепатопротекторного средства в лечении гепатита. До лечения
До лечения После 1 этапа лучевой терапии
После 1 этапа лучевой терапии


 Т-лимфоциты (Е-РОК), % 66,5±2,5 63.6±4.2
Т-лимфоциты (Е-РОК), % 66,5±2,5 63.6±4.2 Показатели
Показатели
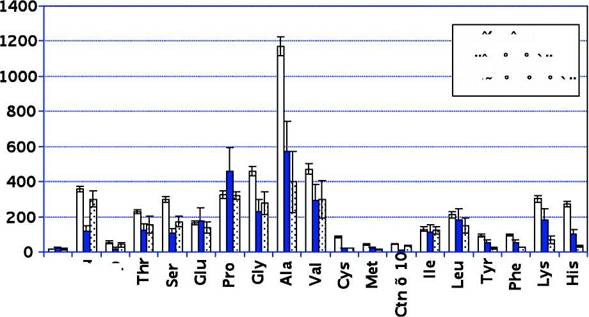




 Рис.31. Содержание свободных аминокислот в плазме крови у больных ОАСНК III-IV стадии (контроль, до - и после лечения) на фоне применения В — таурина, мкМ * — р < 0,05 по отношению к контролю
Рис.31. Содержание свободных аминокислот в плазме крови у больных ОАСНК III-IV стадии (контроль, до - и после лечения) на фоне применения В — таурина, мкМ * — р < 0,05 по отношению к контролю ПРЕПАРАТОВ
ПРЕПАРАТОВ