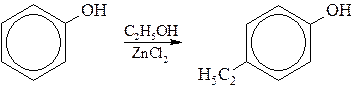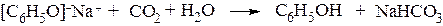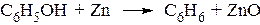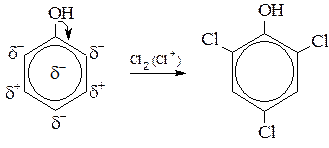|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Источники и методы получения
Важным источником фенола и крезолов является каменноугольная смола. Причём выход фенолов тем выше, чем ниже температура коксования. Дополнительное количество фенола получают из бензола несколькими методами. – Щелочное плавление солей бензолсульфокислот. Это старый метод и в промышленности используется всё реже.
Выход фенола 60 %…70 %. –Некоторое количество фенола получаютгидролизом хлорбензола, перегретым до температуры 450 °C…500 °C паром. Катализатор – силикагель, промотированный ионами Cu+2.
– Кумольный метод (разложение гидроперекиси изопропил-бензола (кумола)). Процесс состоит в следующем:
– Замещение диазогруппы.Этот метод неэкономичен для получения фенола, но с успехом используется для синтеза индивидуальных о-, м- и п-крезолов.
–Гомологи фенола получают егоалкилированием.
Физические свойства Фенолы – обычно кристаллические вещества, плохо растворимые в воде. Имеют характерный запах. Являются антисептиками, ядовиты, вызывают ожоги при попадании на кожу. Фенол: tплав. = 41 °C; tкип = 182 °C; d420 = 1,072; Крезолы: о- 30 °C; 191,5 °C; 1,0465; м- 11 °C; 202,8 °C; 1,034; п- 36 °C; 202,5 °C; 1,035. Химические свойства Фенолы обладают весьма реакционноспособной гидроксильнойгруппой и ароматическим ядром. – Фенолы – слабые кислоты. Кислотность их выше, чем у спир-тов и воды, но как кислоты они слабее угольной кислоты и карбоновых кислот. Так, константы диссоциации уксусной кислоты 1,8·10-5, угольной кислоты 4,9·10-7, фенола 1,3·10-10 и воды 1,8·10-16. Кислотные свойства фенольного гидроксила вызваны мезомерным взаимодействием с ароматическим ядром. Валентные электроны атома кислорода вступают в систему сопряжения бензольного кольца, а водородный атом гидроксила протонизируется и становится активным. Фенолы хорошо растворяются в щелочах с образованием фенолятов (одноатомные насыщенные спирты со щелочами не реагируют).
Однако они не вытесняют CO2 из карбоната натрия (Na2CO3). Более того, фенолы выделяют из растворов фенолятов обработкой CO2.
Две эти реакции используются для выделения фенолов из смесей их со спиртами или карбоновыми кислотами.Кислотность фенольного гидроксила может быть значительно повышена при введении в ядро сильных электроноакцепторных групп – Образование простых эфиров фенолов алкилированием фенолятов.
– Сложные эфиры при действии на фенолы карбоновых кислот не образуются.Они получаются в реакции фенолятов с ангидридами или галоидангидридами кислот.
– Обычные реакции замещения гидроксила на галоген из-за кислотности фенольного гидроксила даже при действии PCl5 не идут. –При перегонке с цинковой пылью фенолы восстанавли-ваются до углеводородов.
–Гидроксил – один из сильнейших, а в щелочной среде сильнейший орто-пара-ориентант. Поэтому фенолы легко вступают в реакции электрофильного замещения в ядре. Галоидированиефенолов действием растворов галогенидов или галогенирующих средств (например, SOCl2, PCl5) идёт с большой скоростью до образования тригалогенфенолов.
Нитрование фенолов.Мононитрофенолы получают нитрованием фенолов на холоду ~30 %-ной азотной кислотой. При дальнейшем нитровании концентрированной азотной кислотой получается 2,4,6-тринитрофенол (пикриновая кислота). – Гидрирование водородом в присутствии катализаторов (Pt, Pd, Ni) даёт циклогексановые спирты.
– Реакция конденсации При нагревании фенола с муравьиным альдегидом в присутствии серной кислоты образуется растворимый в спиртах, ацетоне и т.д. полимер линейного строения, так называемый «новолак».
В щелочнойсреде получаются фенолоспирты, а из них – легкоплавкий низкомолекулярный полимер «резол», хорошо растворимый в органических растворителях.
При дальнейшей конденсации резола (нагрев) образуется нерастворимый полимер – резит, бакелит (с наполнителем). Резит – неплавкий, нерастворимый, химически устойчивый полимер, который можно нагревать до температуры ~ 300 °C. Фенол-формальдегидные полимеры имеют очень широкое применение в народном хозяйстве. Фенол– кристаллическое вещество с tплав. = 43 °C и tкип = 181 °C. Плохо растворим в воде и даёт с ней гидрат, называемый карболовой кислотой. Фенол вызывает ожоги кожи. Антисептик. Фенол широко используется промышленностью для получения фенолформ-альдегидных пластических масс, лекарственных препаратов (например, салициловая кислота и её производные), красителей, взрывчатых веществ (пикриновая кислота – меленит). Метиловый эфир фенола – анизол – используется для получения пахучих веществ и красителей. Крезолы.Крезолыприменяются в производствах пластических масс, красителей, дезинфицирующих средств. Пирокатехин (1,2-дигидроксибензол с хлорным железом даёт зеленое окрашивание). Встречается во многих растениях, в основном в виде его метилового эфира – гваякола, который находит фармацевтическое и пищевое применение.
Резорцин (1,3-дигидроксибензол), tплав = 118 °C, tкип = 276 °C. С хлорным железом даёт фиолетовую окраску. Применяется для получения красителей и как дезинфицирующее средство. Гидрохинон (1,4-дигидроксибензол), tплав = 170 °C, tкип = 286 °C. Гидрохинон очень легко окисляется до хинона. Гидрохинон используется в фотографии как проявитель. Из его производных получают термостойкие поликонденсационные смолы.
38. По общей формуле CnH2n+2Oнасыщенные простыеэфиры являются изомерами спиртов. Изомерия и номенклатура простых эфиров определяется характером радикалов:
Способы получения Обычными способами получения простых эфиров являются : – Дегидратация спиртов в присутствии кислот.
В присутствии серной кислоты реакция протекает через образование алкилсерной кислоты.
– Реакция Вильямсона – взаимодействие галоидных алкилов с алкоголятами.
Физические свойства Метиловый и метилэтиловый эфиры при обычных условиях – газы. Остальные эфиры – жидкости. Температуры кипения простых эфиров значительно ниже, чем у изомерных им спиртов. Диметиловый эфир кипит при температуре –23,7 °C, а этиловый спирт – при температуре 78,4 °C, диэтиловый эфир кипит при температуре 35,6 °C, а бутиловый спирт – при температуре 117,5 °C. Это обстоятельство объясняется отсутствием в эфирах гидроксильного водорода, способного к образованию водородной связи. Эфиры плохо растворимы в воде, плотности их ниже единицы. Химические свойства Простые эфиры – устойчивые малоактивные соединения. Они не реагируют на холоду с разбавленными минеральными кислотами, щелочами, металлическим натрием, пятихлористым фосфором. – С галогеноводородными кислотами простые эфиры образуют комплексы. При этом протон кислоты присоединяется к кислороду эфира за счёт его неподелённой пары электронов.
– Иодистоводородная кислота разлагает эфиры уже на холоде
– Металлический натрий также расщепляет эфиры при нагревании
Диэтиловый эфир Из всех простых эфиров наибольшее значение имеет диэтиловый эфир. Получают его дегидратацией этанола. tкип.= 35,6 °С, d420 =0,7135 г∙см-3, растворимость в воде – 6,5 г на
Поиск по сайту: |