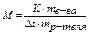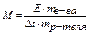|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Коллигативные свойства растворов неэлектролитов308)Насыщенный пар
коллигативные – «общие» свойства коллигативные - свойства растворов неэлектролитов «общие» для всех растворов коллигативные свойства не зависят от природы неэлектролита коллигативные - свойства растворов неэлектролитов, если эти растворы рассматривать как идеальные при этом при вычислении одного коллигативного параметра определяются другие параметры ПР: давление насыщенного пара, температура кипения и температура замерзания, осмотическое давление
- давление насыщенного пара р-теля над чистым р-телем выше, чем давление насыщенного пара р-теля над р-ром р0> р в-во, занимая часть объема р-ра, снижает концентрацию р-теля р-тель меньшей концентрации создает меньшее давление насыщенного пара р-теля над р-ром есть разность давления насыщенного пара р-теля над чистым р-телем и давления насыщенного пара р-теля над р-ром Dр = р0– р 314)эбуллиоскопическая и криоскопическая константа309)закон Рауля для идеального раствора разность давления насыщенного пара растворителя пропорциональна мольной доле растворителя в растворе Dр = К× cр-теля, где К – постоянная Рауля, c р-теля - мольная или молярная доля растворителя относительная разность давления насыщенного пара р-теля равна мольной доле растворенного в-ва
- Ткип чистого растворителя ниже, чем Ткип раствора ПР: Ткип водных растворов выше 100°С кипение – испарение, которое идет и на поверхности, и внутри жидкости кипение начинается, когда давление насыщенного пара уравнивается с атмосферным давлением температура начала кипения – температура кипения Ткип если испарение при кипении – равновесное состояние системы жидкость Û газ, то влияние внешних факторов оценивается по принципу Ле-Шателье: если у раствора снижается давление насыщенного пара, то р-р придется дополнительно нагреть, чтобы повысить давление пара до восстановления равновесия разность температуры кипения чистого р-теля и р-ра пропорциональна моляльной концентрации раствора Dt = Е× C для идеального раствора, где Е – эбулиоскопическая константа,равная разности температуры кипения при единичной концентрации р-ра
, где l - удельная теплота испарения растворителя в ../г
эбулиометрия – метод определения разности температуры кипения растворов и растворителя по разности температуры кипения раствора и растворителя определяют моляльную концентрацию раствора
- Тзамерз чистого растворителя выше, чем Тзамерз раствора ПР: Тзамерз водных растворов ниже 0°С если плавление – равновесное состояние жидкость Û твердое тело, то влияние внешних факторов оценивается по принципу Ле-Шателье: если у раствора концентрация р-теля снижается – значит равновесие жидкость Û твердое тело смещается, активируется процесс плавления, который останавливается при более низкой температуре температура начала плавления или начала кристаллизации(замерзания) – температура замерзания Тзамерз разность температуры замерзания пропорциональна моляльной концентрации раствора Dt = К× C для идеального раствора, где К – криоскопическая константа, равная разности температуры плавления при единичной концентрации р-ра
, где l – удельная теплота плавления растворителя в ../г
криометрия – метод определения разности температуры кипения растворов по разности температуры плавления раствора и растворителя определяют моляльную концентрацию раствора
по температурам кипения и замерзания раствора рассчитывают молекулярную массу растворенного вещества
Диффузия диффузия – взаимное проникновение молекул-атомов-ионов одних веществ между молекулами-атомами-ионами других в результате теплового(броуновского) движения молекул-атомов-ионов в направлении увеличения энтропии системы диффузия наблюдается у газов-жидкостей-твердых тел в растворах за счет диффузии происходит выравнивание концентрации в-в: в-во из области высокой концентрации перемещается в область низкой концентрации концентрационный градиент при диффузии вещество из области высокой концентрации перемещается в область низкой концентрации разность концентраций С двух точек, отнесенная к расстоянию х между ними, есть концентрационный градиент DС / Dх = grad С Закон Фика 304)коэффициент диффузии для диффузии в растворах, не разделенных мембранами скорость диффузии пропорциональна концентрационному градиенту и площади, через которую идет диффузия dn /dt = - D × S × grad С, где D - коэффициент диффузии в м2/сек, S - площадь, через которую идет диффузия dn /dt – скорость диффузии в количестве молей переносимого в-ва за единицу времени (моль/сек) анализ уравнения: скорость диффузии тем больше – чем больше коэффициент диффузии-градиент концентрации-площадь мембраны *А.Эйнштейн М.Смолуховский предложили формулу расчета коэффициента диффузии
, где R – универсальная газовая постоянная R =8,31 Дж/моль×К, Т – абсолютная температура в К, NA - постоянная Авогадро NA =6,02×1023 моль-1, h - вязкость среды r - радиус частиц в-ва анализ уравнения: - чем больше температура, тем больше коэффициент диффузии - чем меньше вязкость среды, тем больше коэффициент диффузии - чем меньше радиус частиц в-ва, тем больше коэффициент диффузии радиус частиц в-ва увеличивается с ростом молярной массы поэтому чем больше молярная масса в-ва, тем меньше коэффициент диффузии
Поиск по сайту: |
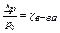
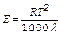 эбулиоскопическая константа зависит от удельной теплоты испарения р-теля и рассчитывается по формуле
эбулиоскопическая константа зависит от удельной теплоты испарения р-теля и рассчитывается по формуле криоскопическая константа зависит от удельной теплоты плавления р-теля и рассчитывается по формуле
криоскопическая константа зависит от удельной теплоты плавления р-теля и рассчитывается по формуле