 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Свойства воды как растворителя
вода – растворитель, самый распространенный в природе свойства воды как растворителя: - высокая диэлектрическая проницаемость - вода активно растворяет вещества с полярными молекулами - образование водородных связей между частицами в-ва и молекулами воды - низкая вязкость воды свойства воды как растворителя определяются строением молекул воды строение молекулы воды
H - \ О(II)-2 хим.связь одинарная полярная ковалентная, Ð105°
H+ - молекула в виде диполя: 2 неподеленные е-пары атома кислорода образуют (-)полюс + 2 катиона водорода образуют (+)полюс + диполи воды активно растворяют вещества с полярными молекулами: полярные - молекулы неорганических веществ, имеющие или ионные связи, или полярные ковалентные связи полярные - молекулы органических веществ, имеющие полярные функциональные группы полярные молекулы имеют свойства диполей электрический диполь - два точечных заряда, одинаковые по величине и противоположные по знаку, находящиеся на расстоянии l друг от друга, которое называется плечом диполя Р = q × l - электрический момент диполя различают молекулы с постоянной полярностью – жесткие диполи, и молекулы с непостоянной полярностью – индуцированные диполи диполи воды вызывают электролитическую диссоциацию растворяемых в-в или распад в-в на ионы: растворяемые в-ва должны иметь ионные или полярные ковалентные связи вокруг частиц растворяемого в-ва диполи воды образуют гидратные оболочки
ПР: HCl полярная ковалентная связь в-во находится в растворенном виде, в электрическом поле диполя H+Сl- диполи Н2О располагаются упорядоченно, взаимодействие диполей Н+Cl- и упорядоченно расположенных диполей Н2О поляризует связь Н+-Cl- до ионной взаимодействие диполей Н+-Сl- и упорядоченно расположенных диполей Н2О ослабляет связи Н+-Cl-,
физическая фаза ®химическая фаза: в электрическом поле ионов Н+ и Сl- диполи Н2О располагаются упорядоченно ® гидраты ионов Сl- и ионы гидроксония Н3О+ (донорно-акцепторная связь)
NaCl ионная связь, ионная кристаллическая решётка в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно, взаимодействие ионов Na+ и Cl- и диполей Н2О ослабляет связи Na+-Cl-, образуются ионы Na+ и Cl- (одновременно идет растворение и диссоциация) физическая фаза ®химическая фаза: в электрическом поле ионов Na+ и Сl- диполи Н2О располагаются упорядоченно ® гидраты ионов Na+ и Сl-
NaОН ионная связь, ионная кристаллическая решётка в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно, взаимодействие ионов Na+ и ОН- и диполей Н2О ослабляет связи Na+-ОН-, образуются ионы Na+ и ОН- (одновременно идет растворение и диссоциация) физическая фаза ®химическая фаза: в электрическом поле ионов Na+ и ОН- диполи Н2О располагаются упорядоченно ® гидраты ионов Na+ и гидроксид-ионы ОН- гидрофильное и гидрофобное взаимодействие веществ с водой вещества по растворимости в воде делятся на гидрофильные и гидрофобные - гидрофильные хорошо растворяются в воде состоят из ионов и полярных молекул или молекул с полярными функциональными группами варианты гидрофильного взаимодействия – ионно-дипольное ПР: растворение NaCl диполь-дипольное ПР: растворение HCl образование водородных связей ПР: растворение С2Н5ОН - гидрофобные плохо растворяются в воде состоят из неполярных молекул гидрофобное взаимодействие – «отталкивание» молекул воды от молекулы в-ва - дифильные, у которых молекулы имеют и гидрофильные, и гидрофобные группы дифильные молекулы при растворении в воде деформируются так, чтобы контакт с водой гидрофобных групп уменьшился, а контакт с водой гидрофильных групп увеличился ПР: в воде белковые молекулы приобретают форму глобул внутри глобул гидрофобные группы, снаружи глобул гидрофильные группы
влияние на растворимость природы компонентов, температуры и давления факторы, влияющие на растворимость в-в: - природа растворителя одно в-во в разных растворителях растворяется по-разному 289) природа в-ва.полярные растворители и неполярные растворители. различают полярные растворители и неполярные растворители ПР: вода, спирт – полярные растворители у полярных растворителей полярные молекулы полярные растворители сильно поляризуются и имеют высокую диэлектрическую проницаемость e в полярных растворителях хорошо растворяются в-ва ионной структуры с ионными связями и молекулярной структуры с полярными ковалентными связями в неполярных растворителях хорошо растворяются в-ва молекулярной структуры с неполярными ковалентными..
- природа в-ва в одном растворителе разные в-ва растворяются по-разному некоторые в-ва имеют низкую растворимость ПР: твердые в-ва с прочной атомной кристаллической решеткой практически нерастворимы в-ва с ионной и полярной ковалентной связью хорошо растворяются в полярных растворителях в-ва с неполярной ковалентной связью плохо растворяются в полярных растворителях ПР: одна из причин высокой растворимости в-в – образование связей между частицами в-ва и растворителя ПР: при растворении спирта в воде образуются водородные связи между молекулами воды и спирта ПР: при растворении AgCl в водном растворе NH3 образуются комплексы [Ag(NH3)4]+
- температура и давление, присутствие в растворе других в-в.. если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье внешние факторы – температура, давление, присутствие других в-в.. график зависимости растворимости от температуры – кривая растворимости.. растворимость твердых в-в в жидкостях факторы, влияющие на растворимость твердых в-в в жидкостях: - природа растворителя..
- природа твердого в-ва..
- температура и давление если растворение – равновесное состояние, то влияние внешних факторов оценивается по принципу Ле-Шателье если растворение эндотермический процесс – при нагревании растворимость твердых в-в в жидкостях увеличивается если растворение экзотермический процесс – при нагревании растворимость твердых в-в в жидкостях уменьшается объем системы при растворении твердых тел в жидкостях не меняется – повышение давления не влияет на растворимость твердых в-в в жидкостях
- присутствие в растворе других в-в..
Поиск по сайту: |
 формула молекулы воды H2O
формула молекулы воды H2O / молекула имеет угловую форму _ -
/ молекула имеет угловую форму _ - гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва
гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва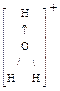 образуются ионы Cl-_и Н+ (свободно не существуют)
образуются ионы Cl-_и Н+ (свободно не существуют)
