 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Лаборатория работа № 4 ⇐ ПредыдущаяСтр 3 из 3
«Определение катионного состава воды» 4.1. Определение общей жесткости воды Приборы, посуда и реактивы: · рН-метр типа pH-12 со стеклянным электродом и электродом сравнения. · Колба мерная по ГОСТ 1770-74 вместимостью 100 см3. · Бюретка по ГОСТ 29251-91 вместимостью 25 см3. · Колба коническая по ГОСТ 25336-82 вместимостью 250 см3. · Соль динатриевая этилендиамин -N, N, N N-тетрауксусной кислоты, 2-водная (трилон Б) по ГОСТ 10652-73. Раствор молярной концентрации вещества c(Na2C10H14N2O8∙2H2O) = 0,05 моль/дм3. · Аммония хлорид по ГОСТ 3773-72 . · Аммиак водный по ГОСТ 3750-79, раствор с массовой долей 25 %. · Из хлорид аммония и аммиака готовят буферный раствор. Берут 10 г хлорида аммония, растворяют в дистиллированной воде, добавляют 50 мл 25 % раствора аммиака и доводят до 500 мл дистиллированной водой. Буферный раствор должен иметь pH = 10,0 + 0,1. · Кислота соляная по ГОСТ 3118-77, раствор молярной концентрации HCI =0,1 моль/дм3 · Натрия сульфид по ГОСТ 2053-77. Готовят раствор путем растворения 3,7 г Na2S∙5H2O в 100 см3 дистиллированной воды. · Хром темно-синий (индикатор) по ГОСТ 14091-78. Для приготовления раствора берут 0,5 г индикатора, растворяют в 20 см3 буферного раствора и доводят до 100 см3 этиловым спиртом. · Спирт этиловый ректификационный по ГОСТ 18300-87. · Вода дистиллированная по ГОСТ 6709-72. Проведение анализа: В коническую колбу внесли 50 см3 отфильтрованной воды и меньший объем, разбавленный до 100 см3 дистиллированной водой. При этом суммарное содержание во взятом объеме воды не превышало 0,5 мг-экв. Затем прибавили 5 см3 буферного раствора, 5-7 капель индикатора и сразу же титровали при сильном взбалтывании раствором трилона Б до изменения окраски из розовой в сине-сиреневую. Титровали по каплям, т.к. для образования окрашенного комплекса требуется определенное время.
Обработка результатов: Общую жесткость воды (Ж), мг-экв/дм3, вычислили по формуле
где V1 - объем раствора трилона Б молярной концентрации с=0,05 моль/дм3, израсходованный на титрование, см3; К - поправочный коэффициент раствора трилона Б молярной концентрации с =0,05 моль/дм3; 2 - коэффициент, учитывающий валентность кальция и магния; V - объем воды, взятой на анализ, см3.
Вывод: Сделав данный опыт, мы определили общую жесткость воды
4.2. Определение ионов кальция, магния, калия и натрия
Приборы, посуда и реактивы: · рН-метр типа pH-121 ос стеклянным электродом и электродом сравнения. · колба мерная по ГОСТ 1770-74 вместимостью 100 см3. · Бюретка по ГОСТ 29251-91 вместимостью 25 см3. · Колба коническая по ГОСТ 25336-82 вместимостью 250 см3. · Капельница по ГОСТ 25335-82. · Цилиндр мерный по ГОСТ 1770-74 вместимостью 10 см3. · Соль динатриевая этилендиамин - N,N,N,N - тетрауксусной кислоты, 2-водная (трилон Б) по ГОСТ 10652-73. Раствор молярной концентрации вещества с(Na2C10H14N2O8∙2H2O)= 0,05 моль/дм3.. · натрия гидроксид по ГОСТ 4328-77. Готовят раствор концентрации 2 моль/дм3. · хром темно-синий (индикатор) по ГОСТ 14091-78. Используется тот же раствор индикатора, что и при определении общей жесткости. · спирт этиловый ректификационный по ГОСТ 18300-87. · вода дистиллированная по ГОСТ 6709-72. Проведение анализа: В коническую колбу внесли 50 см3 отфильтрованной воды, прибавили 2 см3 раствора гидроксида натрия и подождали примерно 5 мин, затем ввели несколько капель раствора индикатора и титровали раствор трилоном Б до изменения окраски из розовой в сине-сиреневую. Обработка результатов: Титрование:
Концентрацию ионов кальция [Ca2+], мг-экв/дм3, вычислили по формуле
Где V1 - объем раствора трилона Б молярной концентрции с=0,05 моль/дм3, израсходованный на титрование, см3.
Для определения концентрации ионов кальция (Х) в мг/дм3 необходимо концентрацию ионов кальция [Са2+] в мг-экв/дм3 умножить на молярную массу эквивалента кальция М(1/2Ca2+) = 20,04: Х=[ Ca2+]∙20,04 Х=1,66∙20,04=33,2664 мг/дм3 Вывод: проделав данный опыт, мы определили концентрацию ионов кальция титрованием пробы воды трилоном Б при рН 12 в присутствии индикатора хром тёмно-синего.
4.3. Определение концентрации ионов магния Концентрация ионов магния [Mg 2+], мг-экв/д, равна разности между общей жесткостью и концентрацией ионов кальция: [Mg 2+] = [Ж] - [Са 2+] [Mg 2+]=2,52-1,66=0,86 мг-экв/д. Концентрация ионов магния (Y) в мг/дм3 равна концентрации ионов магния [Mg2+] в мг-экв/дм3, умноженной на молярную массу эквивалента магния М(1/2) = 12,15: Y = [Mg2+]∙12,15 мг/дм3 Y ==0,86∙12,15=10,449 мг/дм3 4.4. Определение суммарной концентрации ионов натрия и калия
Суммарная концентрация ионов калия и натрия [К+ + Na+] в мг-экв/дм3 равна разности суммарной концентрации всех анионов [A] в мг-экв/дм3 суммарной концентрации ионов кальция и магния [Са2+ + Mg2+]: [К+ + Na+] = [A] - [Са 2+ + Mg2+]. [A]= [К+ + Na+] =22,71-(1,66+0,86)=20,19 мг-экв/дм3 Суммарная концентрация ионов калия и натрия [Z] в мг/дм3 равна величине концентрации, выраженной в мг-экв/дм3, умноженной на молярную массу эквивалента натрия М(Na+) = 23: Z = [К+ + Na+] *23 Z =20,19*23=464,37 мг/дм3 Вывод: Проделав данную лабораторную работу, мы определили обжую жесткость воды, ионов и концентрации кальция, магния, калия, натрия.
Поиск по сайту: |

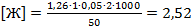 мг-экв/дм3
мг-экв/дм3
 =1,66 мг-экв/дм3
=1,66 мг-экв/дм3 =3,32+0,049+0,542232+9,8=13,711 мг-экв/дм3
=3,32+0,049+0,542232+9,8=13,711 мг-экв/дм3